Chlorure de baryum - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Chlorure de baryum | ||
|---|---|---|

| ||
| Général | ||
| No CAS | ||
| No EINECS | ||
| Apparence | cristaux incolores, inodores. | |
| Propriétés chimiques | ||
| Formule brute | BaCl2 | |
| Masse molaire | 208,233 ± 0,011 g·mol-1 | |
| Propriétés physiques | ||
| T° fusion | 960 °C | |
| T° ébullition | 1 560 °C | |
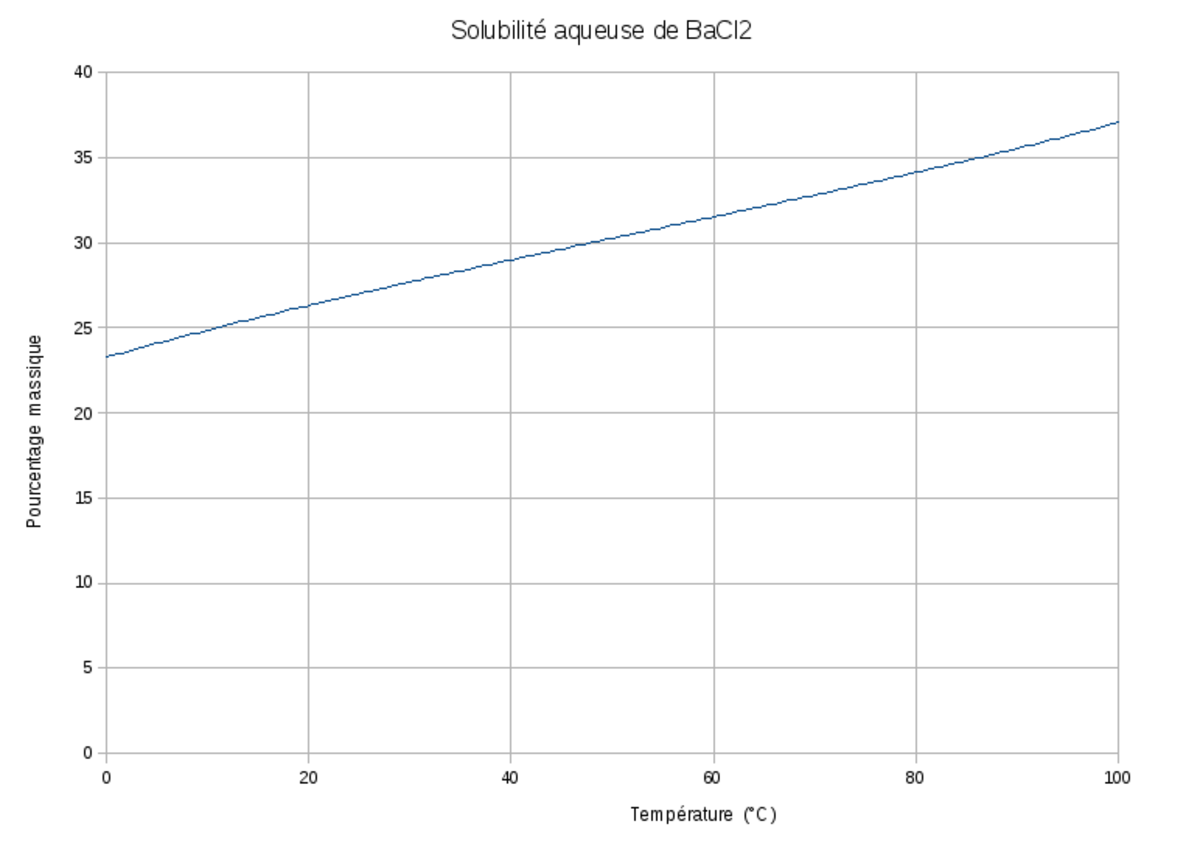
| Solubilité | dans l'eau : 360 g·l-1. 1,7 g dans 100 ml de méthanol | |
| Masse volumique | 3,9 g·cm-3 | |
| Thermochimie | ||
| S0 | 123,7 J/mol·K | |
| ΔH0 | -858,6 kJ/mol | |
| Cristallographie | ||
| Système cristallin | monoclinique | |
| Précautions | ||
| | ||
| ||
| Phrases R : 20, 25, | ||
| Phrases S : (1/2), 45, | ||
| | ||

| ||
| | ||

Danger | ||
| Inhalation | Mal de gorge | |
| Peau | Rougeurs | |
| Yeux | Rougeurs | |
| Ingestion | Douleur, nausée, convulsions, perte de conscience | |
| | ||
Le chlorure de baryum, de formule chimique BaCl2 est un sel de chlore et de baryum de couleur blanche. C'est un composé ionique soluble dans l'eau. Comme la plupart des sels de baryum, c'est un composé relativement toxique. Lorsqu'il est enflammé, il produit une flamme de couleur jaune-verte. Sa forme hydratée la plus fréquente est BaCl2.2H2O.
Propriétés physico-chimiques
Du fait du caractère ionique de la liaison chlore-baryum dû à la différence importante d'électronégativité entre ces deux éléments, le chlorure de baryum possède une bonne solubilité dans l'eau. Il peut notamment réagir avec les ions sulfates en formant un précipité blanc de sulfate de baryum :
BaCl2(aq) + SO42-(aq) → BaSO4(s) + 2 Cl-(aq)
En solution, le chlorure de baryum se comporte comme un sel neutre : le pH de la solution est indépendant de la quantité de sel dissoute.
Utilisation
Le chlorure de baryum est un sel de baryum bon marché qui possède de nombreuses utilisations en laboratoire. Il est notamment utilisé couramment comme test de reconnaissance des ions sulfates. Il est utilisé également pour préparer d'autres sels insolubles par précipitations, comme par exemple l'oxalate de baryum dans la réaction :
BaCl2(aq) + Na2C2O4(aq) → BaC2O4 (s) + 2 NaCl(aq)
Il est utilisé en pyrotechnie pour donner une coloration verte aux flammes, et en métallurgie pour augmenter la dureté de l'acier.
Fabrication
Le chlorure de baryum peut être préparé à partir d'hydroxyde de baryum ou de carbonate de baryum (minerai de Withérite) par une réaction avec l'acide chlorhydrique.
A l'échelle industrielle, il est fabriqué dans un processus en deux étapes à partir de barite (minerai de sulfate de baryum).
BaSO4 + 4 C → BaS + 4 CO (étape nécessitant un chauffage)
BaS + CaCl2 → BaCl2 + CaS (par co-fusion des réactifs)
Le chlorure de baryum est alors extrait du mélange obtenu par dissolution dans l'eau.
Sécurité et toxicité
Le chlorure de baryum est un composé très toxique, une dose de l'ordre de 1g pouvant s'avérer mortelle. Il doit donc être manipulé avec précautions. La valeur limite d'exposition professionnelle est fixée à 0,5 mg·m-3 dans l'union européenne. Par ailleurs, le chlorure de baryum est toxique pour les organismes aquatiques.
Phrases de risque et conseils de prudence

- R: 20 (Nocif par inhalation)
- R: 25 (Toxique en cas d’ingestion)
- S: 1/2 (Conserver sous clé et hors de portée des enfants)
- S: 45 (En cas d’accident ou de malaise consulter immédiatement un médecin et lui montrer l’emballage ou l’étiquette)