Collagène - Définition
La liste des auteurs de cet article est disponible ici.
Dégradation du collagène
Les collagénases
La dégradation du collagène est difficile et nécessite des enzymes particulières, les collagénases (de la famille des métalloprotéinases matricielles). Par exemple, les collagénases d’origine bactérienne (par exemple Clostridium histoliticum, dont le nom d’espèce signifie "destructeur de tissus") sont capables de cliver chaque chaîne de collagène en plus de deux cents points (parmi lesquels X – Gly – Pro – Y). D’autres organismes tels que les amphibiens possèdent des collagénases très spécifiques, capables d’effectuer une seule coupure à un site défini.
Le procollagène
Le procollagène est un assemblage de 3 protéines de collagène alpha ( alpha1 - alpha1 - alpha2 ) en une hélice droite. Les fibres de procollagène s'assemblent en une structure appelée fibrille de collagène. L'assemblage de plusieurs fibrilles de collagène forme la fibre de collagène. Les fibrilles présentent une alternance de phase sombre et claire due a l'espacement et au décalage des fibres de procollagène.
Dans le réticulum endoplasmique
Les trois chaînes de procollagène sont synthétisées transférées dans le lumen du réticulum endoplasmique (on parle de translocation). La région contenant la triple hélice est flanquée d’un peptide signal et de deux propeptides aminoterminal et carboxyterminal. Ceux-ci aident à la maturation de la protéine.
Modifications post-traductionnelles
Une fois dans le réticulum endoplasmique, le peptide signal est clivé. Ensuite intervient l’hydroxylation de plusieurs prolines et lysines. Le propeptide carboxyterminal est modifié par N-glycosylation, tandis que certaines hydroxylysines sont O-glycosylées. Les différentes modifications post-traductionnelles et la formation de ponts disulfure entre les propeptides carboxyterminaux de trois chaînes permettent ensuite leur alignement. La triple hélice s’enroule alors comme une fermeture éclair, en direction de l’extrémité aminoterminale.
Dans l’appareil de Golgi
Enfin, dans l’appareil de Golgi, la triple hélice est flanquée de régions non hélicales. Le propeptide est alors libéré dans le milieu extracellulaire par exocytose. Une enzyme, la procollagène peptidase, clive alors les deux propeptides, permettant la formation de tropocollagène mature. En tout dernier lieu, les faisceaux de tropocollagène s’assemblent à proximité de la surface cellulaire, s’interconnectent et forment des fibres de collagène matures.
Formation des fibres de collagène
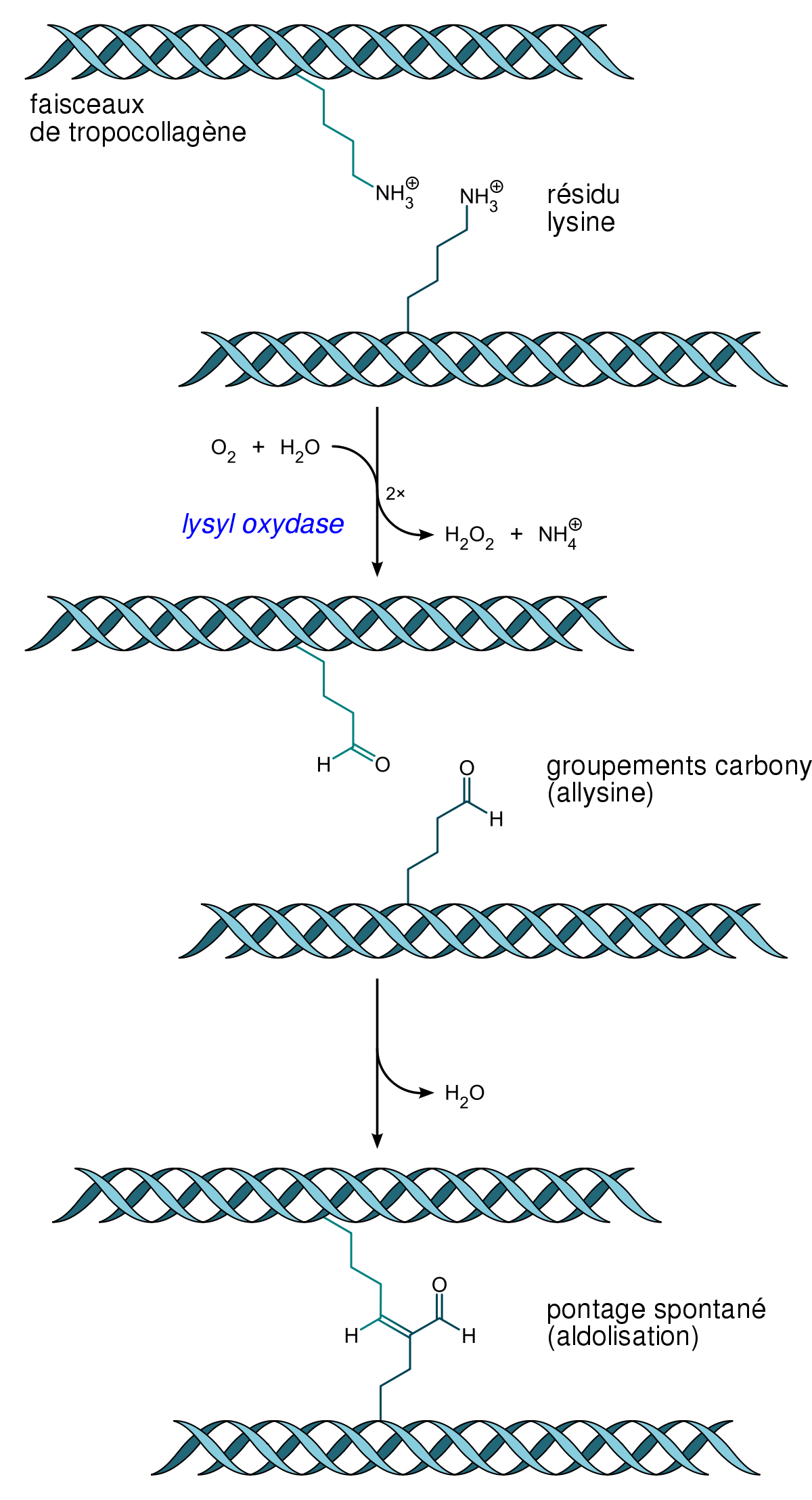
Pour former des fibres de collagène matures, les faisceaux de tropocollagène doivent s’assembler. Divers processus biochimiques y conduisent. Par exemple, une enzyme, la lysyl oxydase, permet la substitution d’un groupement carbonyle au groupement amine d’un résidu lysine, ce qui est à l’origine de pontages spontanés en plusieurs faisceaux de tropocollagène. On procède ainsi à une réticulation des molécules par condensation aldolique.
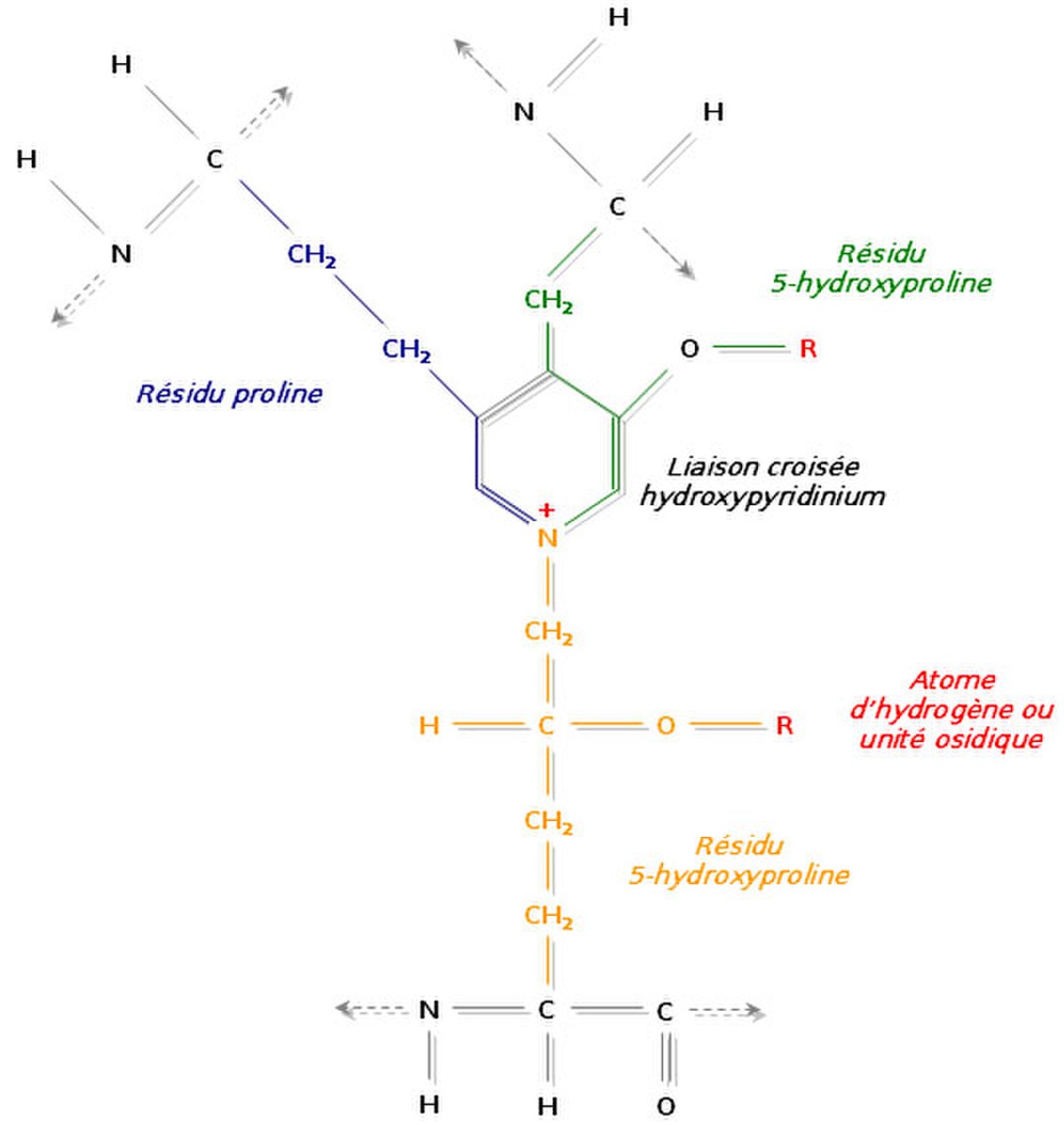
Un autre mécanisme consiste à relier trois régions polypeptidiques par une liaison croisée hydroxypyridinium (ou hydroxypyridinoline). Il se forme alors une structure en échelle qui présente une périodicité de 680 Å, visible en microscopie électronique. Les zones inoccupées entre les différentes molécules de tropocollagène sont remplies à l’aide d’un hydroxyphosphate de calcium, l’hydroxyapatite, de formule Ca10 (PO4)6 (OH)2. La succession régulière de tropocollagène et d’hydroxyapatite est à l’origine de la striation visible en microscopie électronique.