Collagène - Définition
La liste des auteurs de cet article est disponible ici.
Hydroxylation et glycosylation
Hydroxylation
Les deux acides aminés hydroxylés que sont l’hydroxyproline (Hyp) et l’hydroxylysine (Hyl) soulèvent tout naturellement une question : l’hydroxylation intervient-elle avant ou après la synthèse peptidique ? Pour y répondre, les biochimistes ont recherché un aminoacyl-ARNt codant l’un ou l’autre de ces acides aminés. N’en ayant pas trouvé, ils ont conclu que l’hydroxylation de certains résidus de proline et de lysine est un processus post-traductionnel. En fait, deux enzymes catalysent cette réaction. Ce sont respectivement la prolylhydroxylase et la lysylhydroxylase. Toutes deux ne peuvent agir qu’en présence d’ascorbate (ou vitamine C), celui-ci empêchant le fer ferreux (Fe2+) contenu dans leur centre actif d’être inactivé sous forme de fer ferrique (Fe3+). Une carence sévère en ascorbate est à l’origine du scorbut, une maladie due à un défaut de fabrication du collagène, lequel se traduit par une fragilisation des tissus. Les marins, lors des grands voyages, étaient souvent victimes du scorbut, faute de pouvoir consommer des fruits et des légumes.
Les résidus de proline susceptibles d’être hydroxylés sont nécessairement situés à gauche d’un résidu de glycine. Les autres résidus ne peuvent être hydroxylés. Il en va de même pour les résidus de lysine.
(extrémité aminoterminale) NH3+ – … – Pro – Gly – … – COO– (extrémité carboxyterminale)
(extrémité aminoterminale) NH3+ – … – Lys – Gly – … – COO– (extrémité carboxyterminale)
Très rarement, certains résidus de proline sont hydroxylés au niveau du carbone 3 et non du carbone 4. L’enzyme responsable de cette hydroxylation n’est pas la prolylhydroxylase, et l’hydroxylation ne respecte pas les règles que nous venons de définir.
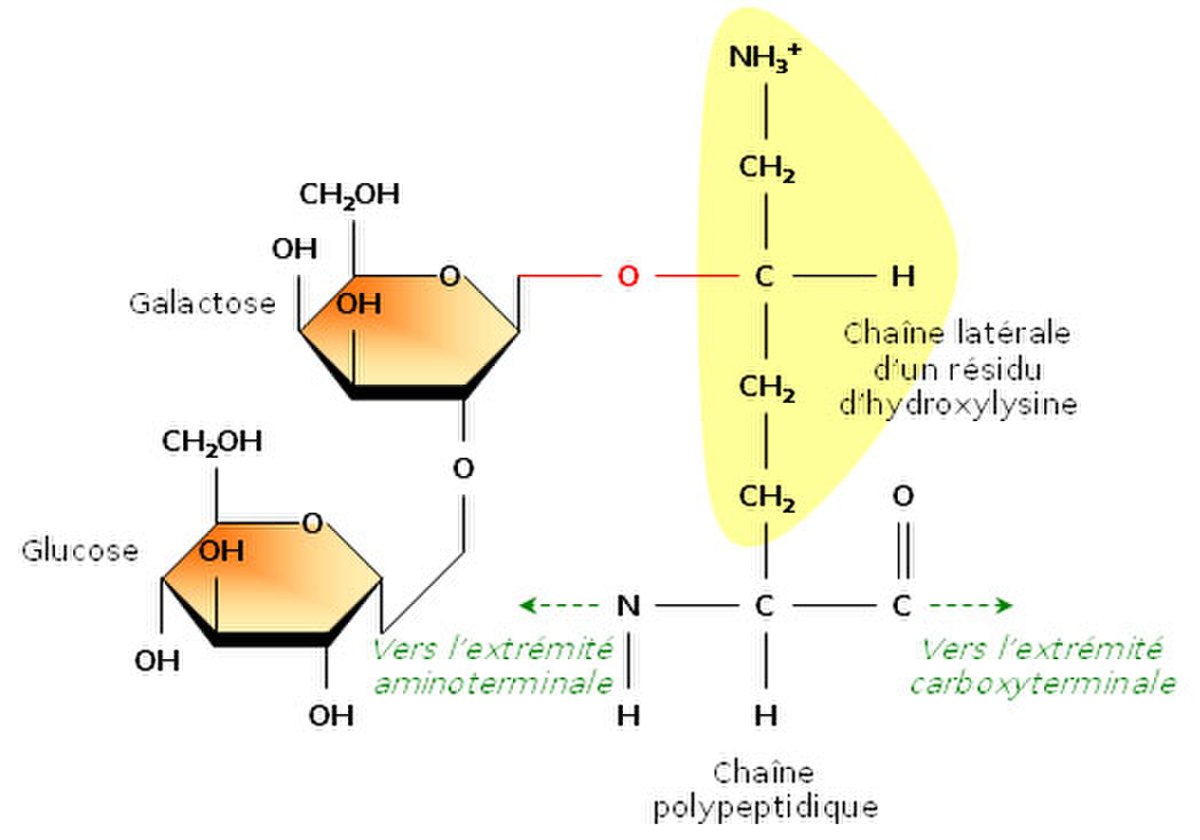
Glycosylation
En étudiant la structure du tropocollagène, les biochimistes ont également montré que certains résidus d’hydroxylysine possédaient des résidus sucrés (2-glucosyl-galactose). Le fait que le collagène soit lié de façon covalente à de courts glucides en fait une glycoprotéine (par opposition aux protéoglycanes, glucides liés à de petits peptides).La formation d’une liaison covalente entre le galactose et le groupement hydroxyle d’un résidu hydroxylysine est catalysée par la galactosyl transférase ; celle du glucose fait appel à la glucosyl transférase.
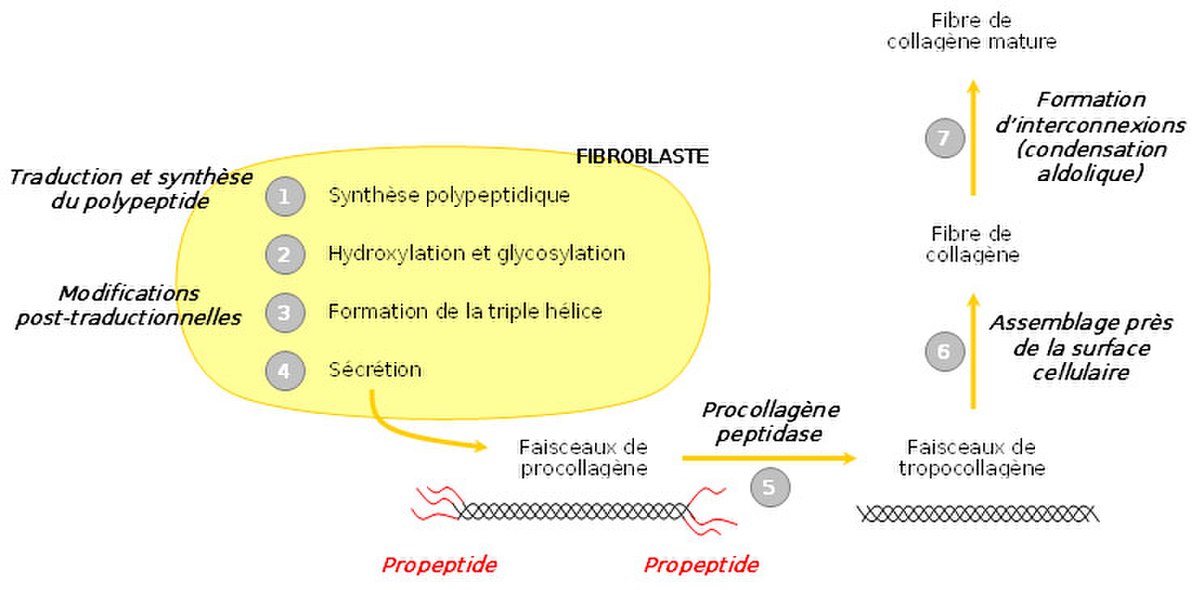
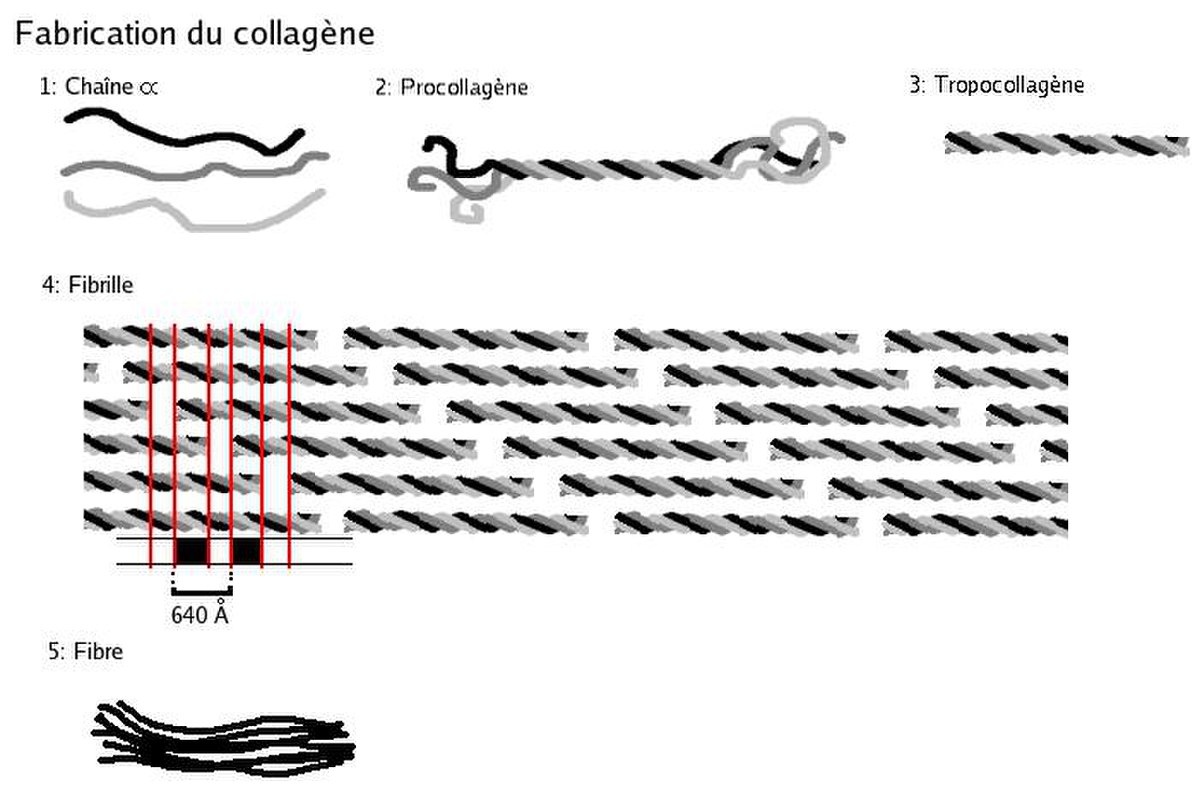
Biosynthèse du collagène
Le procollagène
Le collagène n’a pas sa place dans les cellules elle-mêmes ; c’est pourquoi sa synthèse s’effectue à partir d’un précurseur présent dans les cellules, le procollagène. Celui-ci est constitué de brins beaucoup plus longs, rallongés par des structures polypeptidiques supplémentaires, de 15 kDa du côté aminoterminal et de 30 kDa du côté carboxyterminal. Ces structures sont banales et portent le nom de propeptides. A l’extrémité carboxy-terminale existent des ponts disulfure intercaténaires à rôle stabilisateur. Les ponts sont intracaténaires à l’extrémité aminoterminale.
Importance des hydroxylations
Les hydroxylations observées sur le collagène offrent un gain de stabilité. Leur nombre varie donc en fonction du type de tissu et de la température corporelle. Certains tissus présentent un plus fort taux d’hydroxylation que d’autres. C’est notamment le cas du placenta et de la peau.
| Pro et Hyp (‰) | Température de fusion (°C) | Température corporelle (°C) | |
| Peau de veau | 232 | 39 | 37 |
| Peau de requin | 191 | 29 | 24 à 28 |
| Cabillau | 155 | 16 | 10 à 14 |