Collagène - Définition
La liste des auteurs de cet article est disponible ici.
Le tropocollagène
Le tropocollagène est l'unité fondamentale du collagène, et correspond à une molécule asymétrique de 280nm de long et de 1,5nm de diamètre. Il s'agit d'une glycoprotéine formée par l'enroulement de 3 hélices gauches non α, porteuses de glucide (glucose, galactose). Les acides aminés sont constitués pour un tiers de glycine, pour un quart de proline, d'hydroxylysine et de 4-hydroxyproline. Il existe plusieurs types moléculaires de chaînes α. Ces chaînes sont constituées par des séquences répétitives de trois acides aminés, dont le premier, la glycine est répété tout au long de la molécule. Les glucides sont fixés sur l'hydroxylysine. L'enroulement des 3 chaînes α, aboutit à la constitution de la molécule de tropocollagène, dont la cohésion est assurée par des liaisons hydrogènes entre la glycine et l'hydroxyproline.
Des acides aminés particuliers
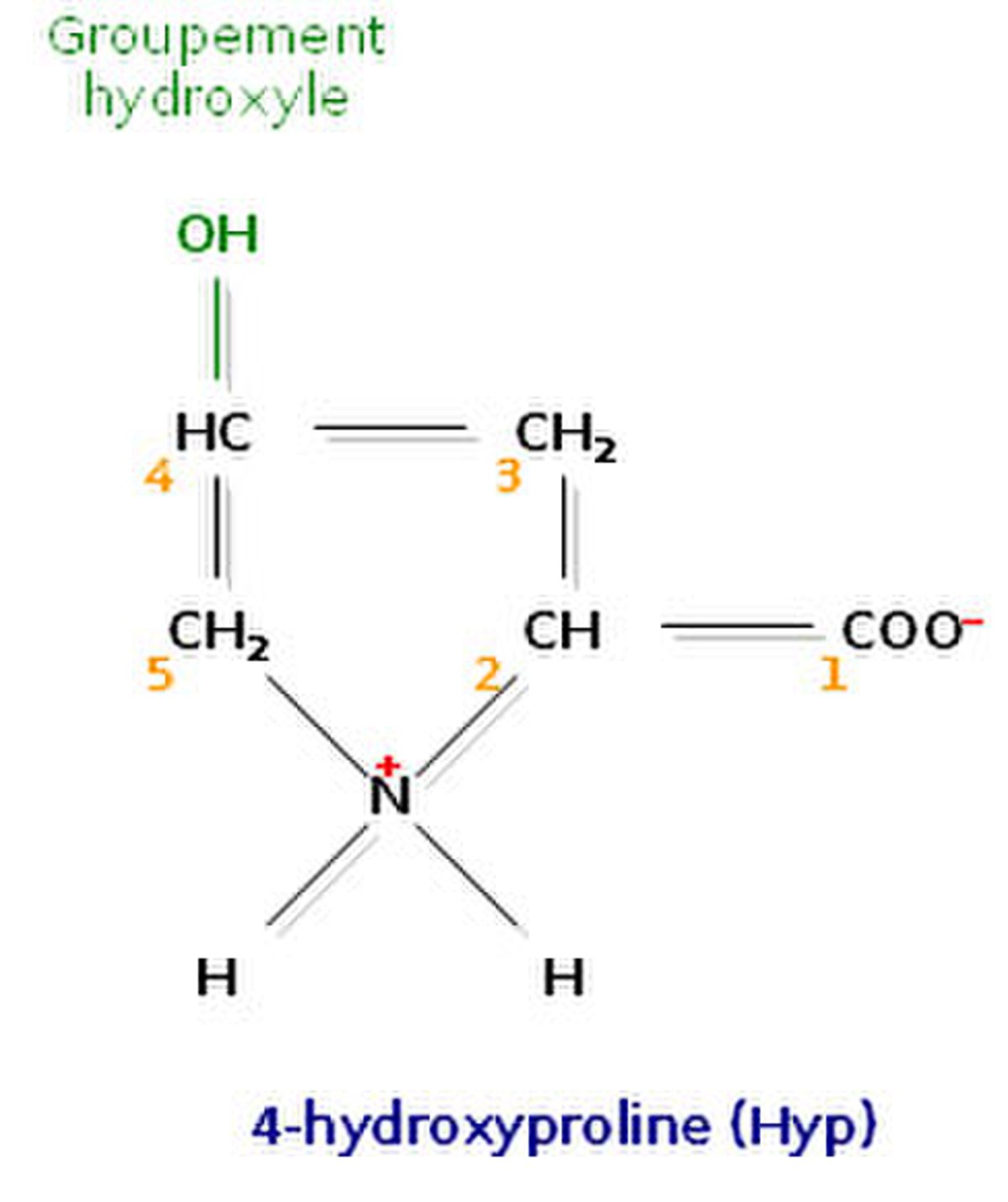
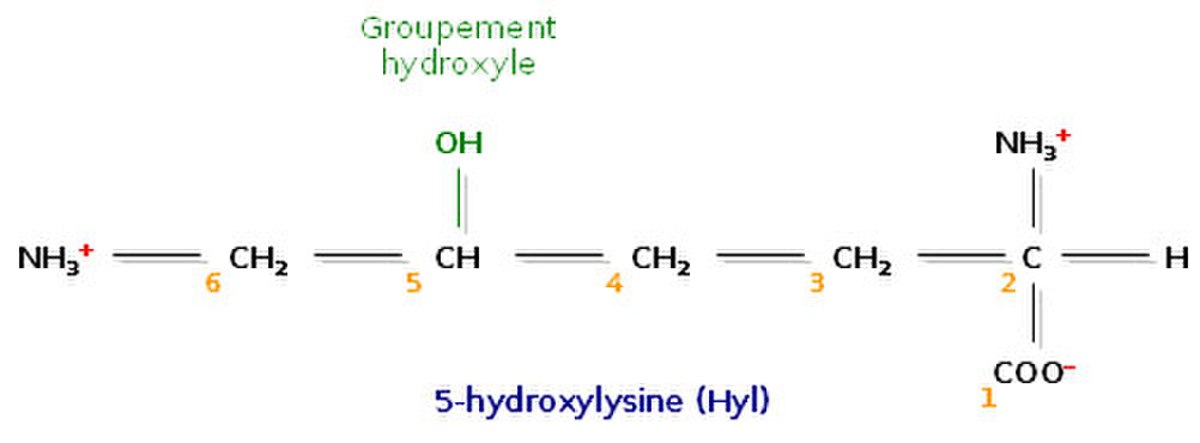
L’analyse de la composition d’une molécule de tropocollagène révèle de nombreuses singularités. Les biochimistes ont montré que le tiers des résidus sont des résidus de glycine, ce qui est caractéristique des protéines de structure. Autre fait singulier, plus de 10% des résidus sont des prolines. Enfin, on observe la présence de deux acides aminés peu courants, la 4-hydroxyproline (Hyp) et la 5-hydroxylysine (Hyl).
Une séquence particulière
Les biochimistes ont également constaté que l’ordre d’enchaînement des acides aminés qui composent le tropocollagène présente aussi des anomalies. En d’autres termes, la séquence d’acides aminés ne correspond pas à ce que l’on rencontre habituellement. On observe en effet que les glycines se retrouvent régulièrement tous les trois résidus. La structure de la séquence des acides aminés du collagène est donc (Gly – Xn – Yn)n. De plus, la séquence comporte assez souvent des triplets Gly – Pro – Hyp. Toutes ces propriétés sont singulières dans la mesure où elles ne se retrouvent pas chez la plupart des protéines.
Une colle naturelle
Lorsque le collagène est partiellement hydrolysé, les trois brins de tropocollagène se dissocient. Ils forment ainsi la gélatine, un produit largement utilisé dans l’agroalimentaire. La gélatine a aussi été utilisée dans l’industrie pharmaceutique, en cosmétique et en photographie. Le collagène et la gélatine sont considérés comme des protéines de piètre qualité nutritionnelle car ils ne possèdent pas tous les acides aminés en proportions adéquates.
Le terme collagène signifie « producteur de colle » (le nom vient du mot grec kolla signifiant « colle »). Les propriétés du collagène ont été utilisées par les Egyptiens 2 000 ans av. J.-C.. Les Amérindiens l’utilisaient au Ve siècle. La plus ancienne colle connue est faite à partir de collagène, et date de 6 000 ans av. J.-C. Au début du XXIe siècle, il est utilisé dans les produits de beautés ou comme additif dans certains aliments.
Structure secondaire
Un cylindre hélicoïdal
La conformation spatiale du tropocollagène est celle d’un cylindre hélicoïdal à trois bandes de 300 nm de long et de 1,5 nm de diamètre. Cette protéine ne présente donc pas la forme globulaire classique des protéines fonctionnelles. C’est une tige longue et fine. Chaque bande du cylindre est une chaîne polypeptidique elle-même repliée en hélice ; l’ensemble des trois chaînes forme une tresse particulièrement résistante. En effet, il faut une charge de 10 kg pour casser une fibre de collagène d’un diamètre d’un millimètre.
Structure en hélice droite
Nous avons dit que chaque chaîne polypeptidique est repliée en hélice. Cette structure secondaire est sans rapport avec l’hélice alpha. Il s’agit d’un autre type de structure secondaire. Il s’agit ici d’une hélice gauche dont l’enroulement résulte de la répulsion des cycles pyrrolidines des nombreux résidus de proline. Les cycles pyrrolidines se repoussent mutuellement en raison de leur fort encombrement stérique. L’hélice obtenue est moins compacte que l’hélice alpha (0,15 nm par résidu) puisque l’on a pu mesurer une distance de 0,29 nm par résidu. Enfin, contrairement aux hélices alpha, on n’observe pas de ponts hydrogène intracaténaires. On trouve néanmoins des ponts hydrogène intercaténaires. Les ponts hydrogène mettent en jeu les résidus de glycine (donneurs de protons) et les groupements carboxyle (accepteurs de protons). Lorsque les chaînes se croisent, il est nécessaire de réduire l’encombrement stérique. Ceci est rendu possible par la présence de résidus de glycine, l’acide aminé le moins encombré. Les autres chaînes latérales sont rejetées à l’extérieur de la structure en triple hélice.
Des interactions coopératives
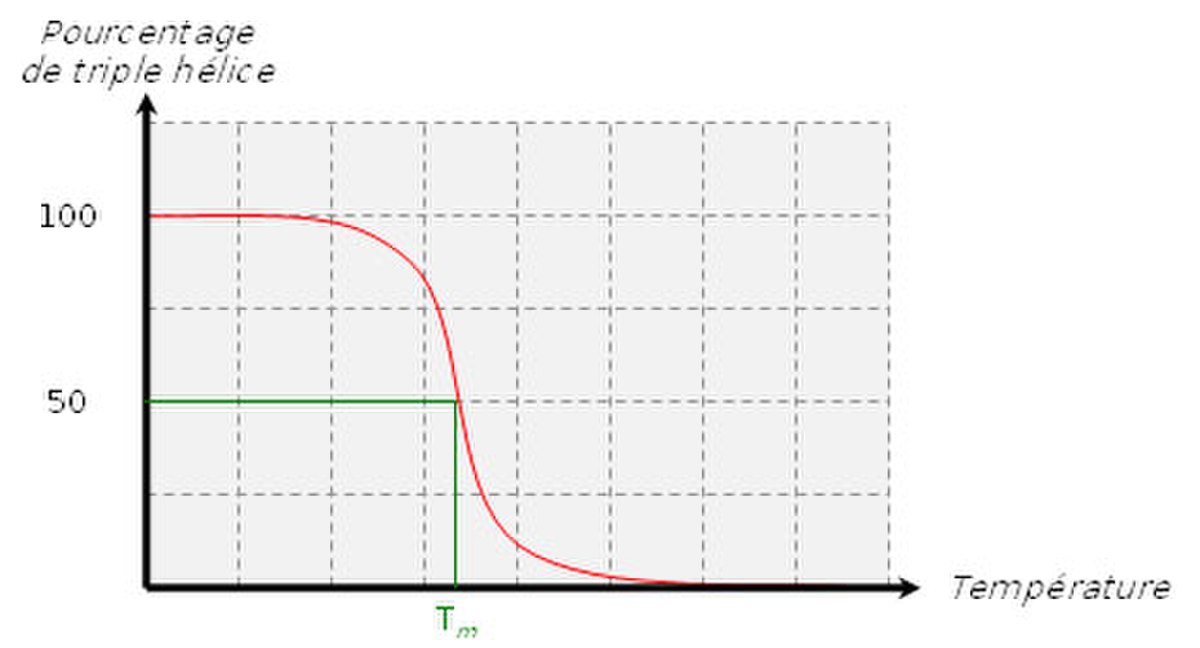
Lorsque l’on chauffe une solution de tropocollagène, on observe un effondrement brusque de la structure en hélice à une température donnée, notée Tm (température de fusion ou melting temperature dans la terminologie anglo-saxone). Cette expérience montre que les ponts hydrogène assurent le maintien de la structure en triple hélice. Ces interactions faibles (c’est-à-dire non covalentes) sont suffisamment nombreuses pour modifier sensiblement le comportement de la molécule. On ne doit pas s’en étonner : la fibroïne, protéine structurale de la soie fabriquée par les araignées, doit son élasticité et sa résistance à l’existence de très nombreux ponts hydrogène qui constituent des interactions coopératives. De la même façon, les propriétés singulières de l’eau, en particulier son point d’ébullition "anormalement" élevé, sont la conséquence directe de l’existence de nombreux ponts hydrogène. La mesure de la température de fusion Tm est rendue possible par le fait qu’elle marque un changement de viscosité de la solution et une modification de la dispersion optique rotatoire (DOR).