Cyclooctatétraène - Définition
La liste des auteurs de cet article est disponible ici.
Synthèse et chimie
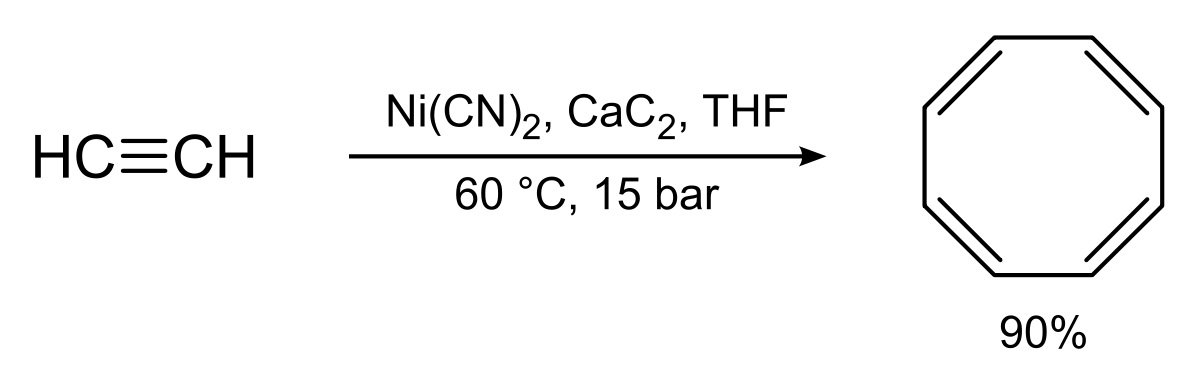
La synthèse originale de R. Willstätter qui nécessite 4 réactions d'élimination sur une structure cyclooctane, donne un rendement relativement bas. La synthèse de Walter Reppe du cyclooctatétraène qui implique de traiter de l'éthyne (acétylène) sous haute pression avec une mélange chaud de cyanure de nickel et de carbure de calcium, est bien meilleure avec un rendement proche de 90%.
Parce que le COT est instable et forme facilement des peroxydes organiques explosifs, une petite quantité d'hydroquinone est habituellement ajoutée au composé commercialement accessible. Il est conseillé de tester les peroxydes avant d'utiliser une bouteille déjà ouverte auparavant. Des cristaux blancs autour du col de la bouteille peuvent être composés de peroxydes qui peuvent exploser quand ils sont sollicités mécaniquement.
Les liaisons π dans le cyclooctatétraène réagissent comme d'habitude pour des oléfines et non comme celles d'un cycle aromatique. Le mono et les poly-époxydes peut être générés en faisant réagir COT avec des acides peroxydés ou avec le diméthyldioxirane. Diverses autres réactions d'addition sont aussi connues. En outre, un polyacétylène stable a été synthétisé via la polymérisation "ring-opening(en)" d'un cyclooctatétraène alkyl-substitué. COT, lui-même, et aussi de dérivés avec de chaînes latérales ont été utilisés comme ligand en particulier pour les complexes sandwich en chimie organométallique.
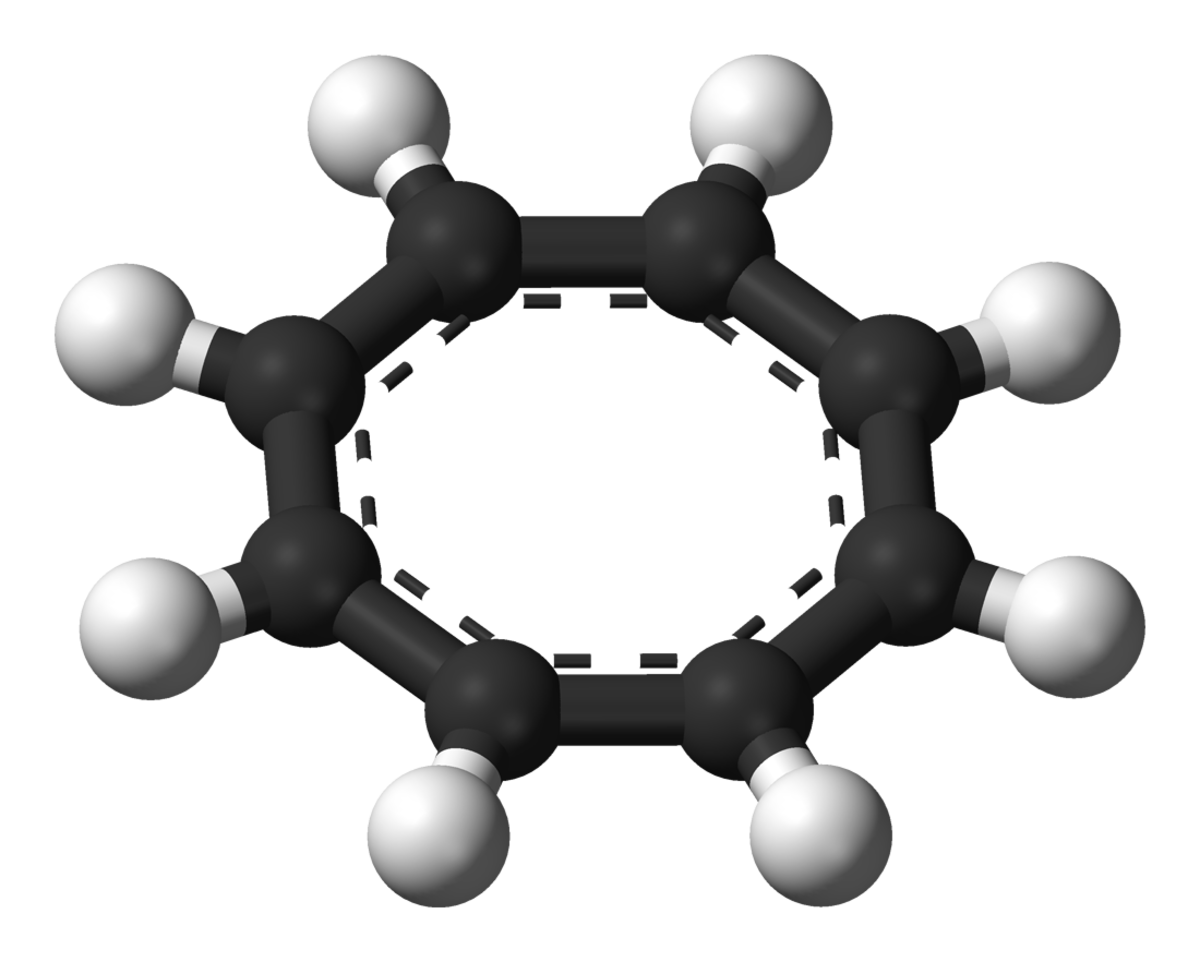
Structure et liaison
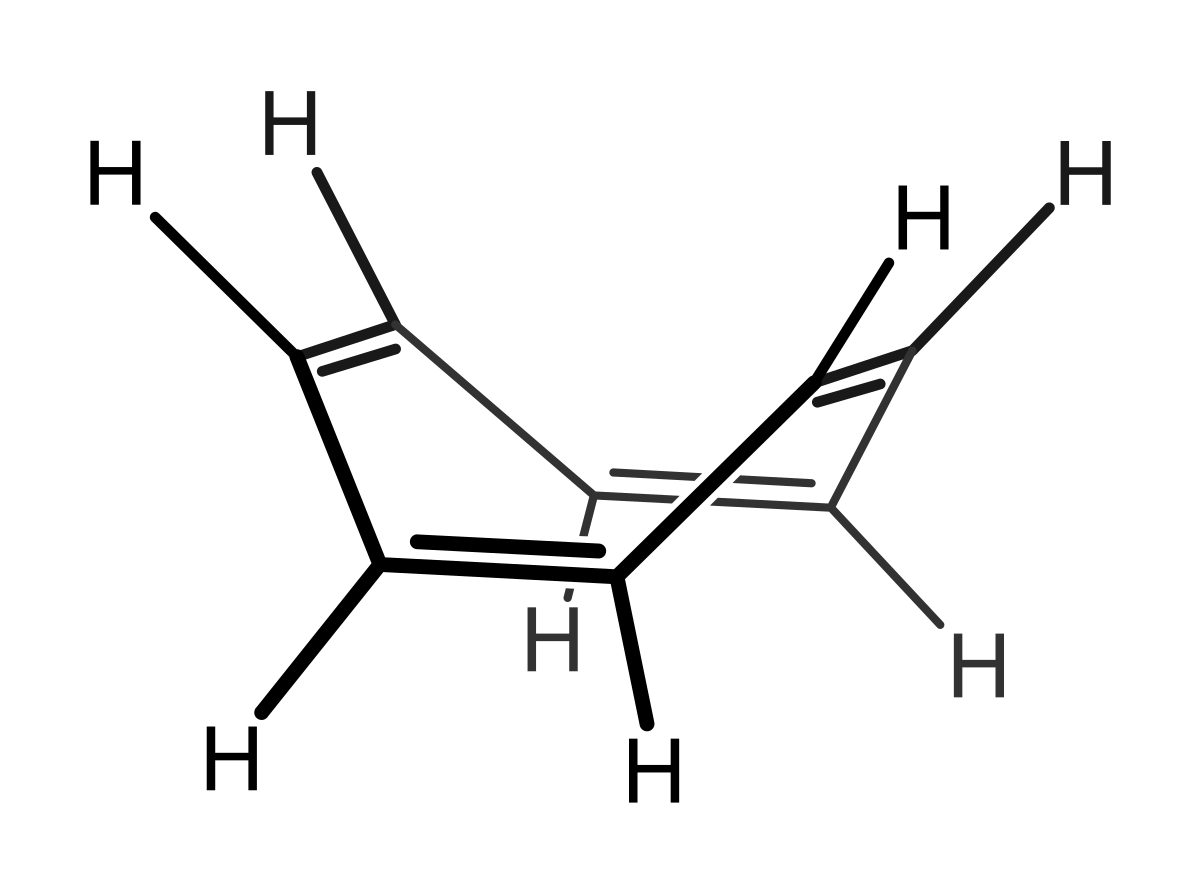
Occurrence naturelle
Le cyclooctatétraène a été isolé dans certains Mycota (Fungi, champignons).L'anion cyclooctatétraènure
COT réagit facilement avec le potassium métal pour former le sel K2COT, qui contient le dianion C8H82−. ce dianion est à la fois plan et aromatique avec un compte d'électron de Hückel de 10.
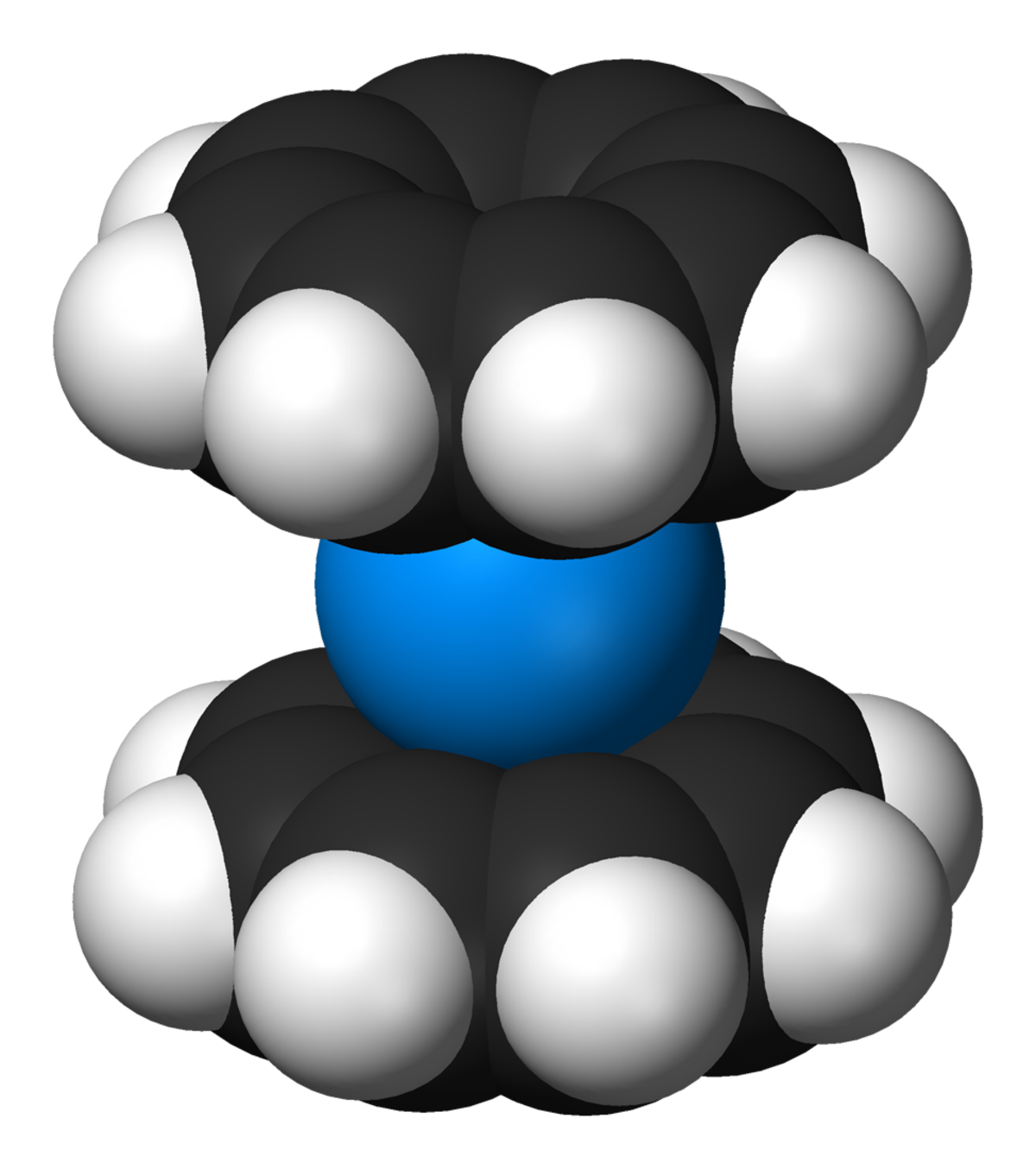
Le cyclooctatétraène forme des complexes avec certains métaux, incluant l'yttrium et les lanthanides. Le composé sandwich EuCOT qui est uni-dimensionnel a été décrit comme des nanofils. les complexes sandwich U(COT)2 ou uranocène, le même dérivé avec du thorium et Fe(COT)2 sont connus.