Dioxyde de manganèse - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Dioxyde de manganèse | |||
|---|---|---|---|

| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | C.I. 77728 C.I. Pigment Black 14 | ||
| No CAS | |||
| No EINECS | |||
| SMILES | |||
| InChI | |||
| Apparence | poudre noire à brune. | ||
| Propriétés chimiques | |||
| Formule brute | MnO2 | ||
| Masse molaire | 86,9368 ± 0,0006 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 553 °C (décomposition) | ||
| Solubilité | dans l'eau : nulle; sol. dans HCl + H2O2 | ||
| Masse volumique | 5,03 g·cm-3 (20°C) | ||
| Thermochimie | |||
| S0 | 53,1 J/mol·K | ||
| ΔH0 | -520,9 kJ/mol | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 20/22, | |||
| Phrases S : (2), 25, | |||
| | |||
| |||
| | |||
|
0 2 1 OX | |||
| | |||


| |||
| | |||

Attention | |||
| | |||
L’oxyde de manganèse (IV) MnO2 est un composé chimique aussi connu comme dioxyde de manganèse. Il est de couleur noire ou brun. On le trouve naturellement dans la pyrolusite, qui est la principale source de manganèse métallique. Il est également présent dans les nodules de manganèse.
Formule
Le dioxyde de manganèse de formule MnO2 est obtenue par oxydation du manganèse de formule Mn. L'équation bilan de cette réaction est simple :
- Bilan: manganèse + dioxygène
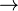
- Équation bilan :Mn + O2
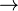
- Équation bilan équilibré :Mn + O2
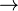
Utilisations
Les principales applications du MnO2 sont les piles sèches comme les piles alcalines et les piles Zn-Cd. En 1976, cette application correspondait à une consommation d’un demi-million de tonnes annuelles de pyrolusite.
MnO2 est aussi utilisé comme matériau d'électrode de supercondensateur.
MnO2 est utilisé comme catalyseur au laboratoire pour la préparation du dioxygène à partir de chlorate de potassium ; c’est une des expériences classiques dans l’enseignement de base de la chimie. Il catalyse aussi la décomposition du peroxyde d’hydrogène :
- 2 H2O2(aq)
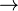
Il est aussi utilisé dans la production de permanganates comme KMnO4. Il est largement utilisé comme oxydant en chimie organique, par exemple, pour l’oxydation des alcools allyliques
Autres oxydes
Une substance grise, le manganate de potassium, est obtenue après une fusion de 10 minutes de l’oxyde de manganèse avec un sel alcalin et ajoutant des agents oxydants comme le salpêtre (nitrate de potassium, KNO3) ou du perchlorate de potassium (KClO4). Le manganate de potassium peut être purifié par distillation sous vide pour donner des cristaux vert foncé (prismes orthorhombiques). Le manganate de potassium n’est soluble que dans les alcalis ; dans les conditions non-alcalines, il se dismute en permanganate de potassium et en oxyde de manganèse(IV) (MnO2), selon l'équation :
- 3 MnO42- + 4 H+
MnO4- a une couleur pourpre. MnO42- a une couleur verte.




















































