Glycoside hydrolase - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
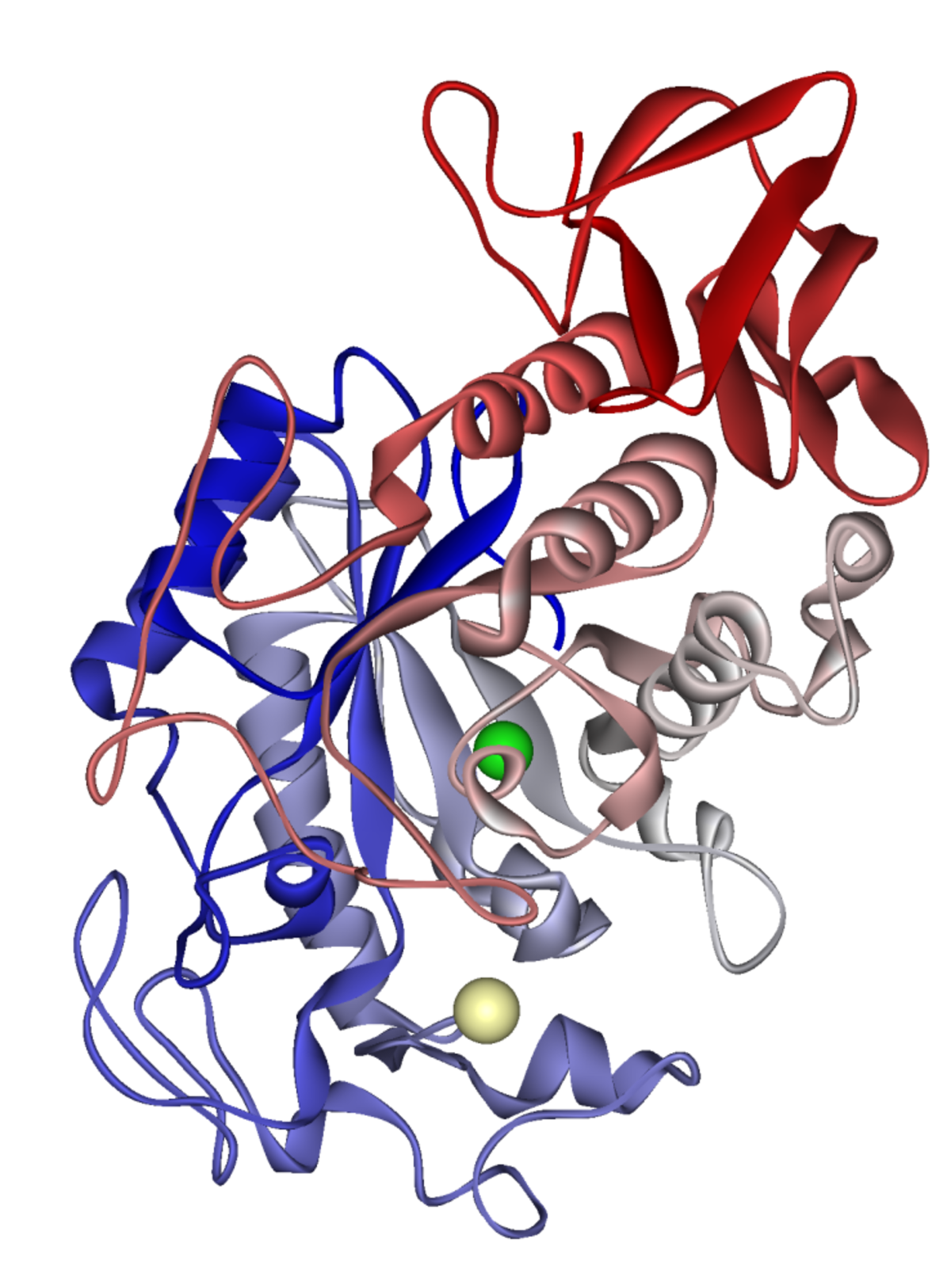
Les Glycoside hydrolases (ou glycosidases) catalysent l'hydrolyse de liaisons glycosidiques et libèrent au moins un composé osidique. Ce sont des enzymes extrêmement communes, dont les rôles sont aussi divers que la dégradation de biomasse (cellulose et hémicellulose), les défenses anti-bactérienes (ex. le lysozyme), la pathogénicité (ex. les neuraminidases virales) ou le métabolisme cellulaire (amylases ou enzyme de débranchement du glycogène pour le métabolisme énergétique, mannosidases comme modulateur de glycosylation des protéines, ...). Les glycosyltransférases et les glycosides hydrolases sont les deux classes majeures d'enzymes impliquées dans la synthèse et la rupture des liaisons osidiques.
![]()
Occurrence et importance
Les glycosidases sont ubiquitaires. Chez les procaryotes on retrouve des glycosides hydrolases intracellulaires et extracellulaires, ces dernières étant largement impliquées dans les processus d'assimilation des nutriments. Une glycosidase notable du règne bactérien est la Β-galactosidase LacZ: Cette enzyme est impliquée dans la régulation de l'opéron lactose longtemps étudié chez E. coli. Chez les organismes supérieurs nombre de glycoside hydrolases sont localisées au niveau du réticulum endoplasmique ou de l'appareil de Golgi où elles jouent différents rôles dans les processus de maturation des protéines. Le lysosome est un organite spécialisé dans la dégradation des macromolécules biologiques. Ils contiennent des glycosides hydrolases actives à pH acides. Plusieurs maladies sont reliées à des déficiences de ces enzymes, pouvant conduire à des problèmes au cours du développement, voire à la mort. Les glycosidases du tractus intestinal et de la salive ont pour rôle la dégradation des glucides complexes, dont l'amidon, en sucres "simples" (une ou deux unités osidiques) qui pourront être assimilés. Par exemple la lactase est indispensable à la dégradation du lactose présent dans le lait. Elle est fortement exprimée chez le nourrisson, mais son taux décroit généralement au après le sevrage, ce qui peut conduire à une intolérance au lactose à l'âge adulte.
Mécanismes
Koshland a publié, en 1953, les mécanismes catalytiques expliquant comment la configuration absolue d'une molécule pouvait être changée -ou non- au cours d'une réaction d'hydrolyse enzymatique. Ces mécanismes sont les plus fréquemment rencontrés au sein des glycosides hydrolases, même si quelques familles d'enzymes possèdent des mécanismes catalytiques particuliers.
Inversion
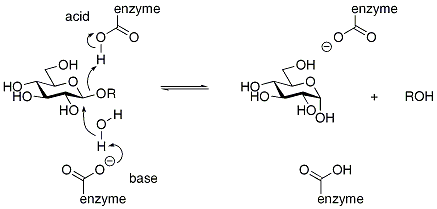
Les glycosidases dont le produit à, pour son carbone anomérique, une configuration absolue inverse de celle maintenu dans le substrat, utilisent un mécanisme inverseur. Ces enzymes utilisent typiquement deux résidus catalytiques, l'un faisant office d'acide et l'autre de base. Le schéma ci-dessous décrit le mécanisme d'une β-glucosidase au mécanisme inverseur, tel que décrit par Koshland. On notera qu'il manque une étape de transfert de proton, qui a généralement lieu via une ou des molécules d'eau, pour régénérer l'enzyme.
Rétention
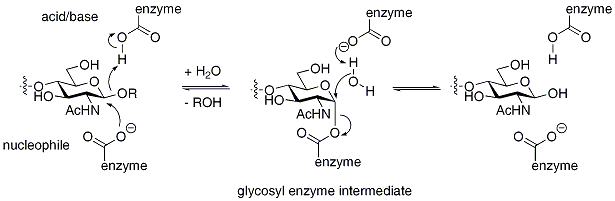
Les glycosidases dont le produit a, pour son carbone anomérique, une configuration absolue identique de celle maintenue dans le substrat, ont un mécanisme rétenteur (ou conservateur). Typiquement ces glycosidases ont un mécanisme en deux temps, chacune des étapes aboutissant à l'inversion de la configuration absolue du carbone anomérique du produit. Ce sont à nouveau deux résidus -portant généralement un groupe acide carboxylique (acide aspartique ou glutamique)- qui catalysent ces deux étapes. Dans la première partie, une base joue le rôle de nucléophile et attaque le carbone anomérique (carbone 1' du produit), ce qui aboutie à la formation d'un intermédiaire covalent glycosyl-enzyme. L'acide participe à l'élimination de la partie aglycone du substrat en lui fournissant un proton. Une molécule d'eau peut alors prendre la place de l'oxygène de la liaison osidique rompue, et activée par l'acide aminé déprotoné au cours de la première étape, réaliser l'hydrolyse du conjugué glycosyl-enzyme, en inversant à nouveau la configuration absolue du produit. Le produit final possède donc la même configuration absolue que celle observée au sein du substrat. Le mécanisme est illustré ci-dessous pour le lysozyme de blanc d'œuf.
Un mécanisme alternatif rétenteur fait intervenir un groupe nucléophile du substrat plutôt qu'appartenant à l'enzyme. Ce mécanisme peut être rencontré chez certaines N-acetylhexosaminidases, dont le groupe acétamido du substrat, à proximité du centre actif, peut participer à la catalyse. Décrit pour les familles 4 et 109, un autre type de mécanisme fait intervenir un cofacteur d'oxydoréduction : le NAD. L'hydrolyse est alors catalysée par l'oxydation du substrat, ce qui génère, en intermédiaire, un sucre insaturé, lors de la béta élimination de la partie aglycone du substrat. Lors de l'attaque d'une molécule d'eau sur l'intermédiaire, le produit saturé est régénéré et libéré.