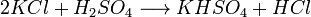Hydrogénosulfate de potassium - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
Introduction
| Hydrogénosulfate de potassium | |||
|---|---|---|---|

| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | bisulfate de potassium | ||
| No CAS | |||
| No EINECS | |||
| No RTECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule brute | HKO4S | ||
| Masse molaire | 136,169 ± 0,006 g·mol-1 | ||
| Propriétés physiques | |||
| Solubilité | 490 g·l-1 (eau,20 °C) | ||
| Masse volumique | 2,24 g·cm-3 (solide,20 °C) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 34, 37, | |||
| Phrases S : 1/2, 26, 36/37/39, 45, | |||
| | |||
| |||
| | |||
|
0 1 0 | |||
| | |||

| |||
| Écotoxicologie | |||
| DL | 2,34 g·kg-1 (rat, oral) | ||
| | |||
L'hydrogénosulfate de potassium est un sel de formule chimique KHSO4.
Production et synthèse
Une voie de synthèse est le procédé Berlin où l'acide sulfurique réagit avec du chlorure de potassium pour donner un mélange d'hydrogénosulfate de potassium et de disulfate de potassium, K2S2O7. De l'acide chlorhydrique relativement pur est produit comme coproduit.
Le sel et l'acide sont mélangés dans un four et chauffé jusqu'à 300 °C pour former une pâte. Le chlorure d'hydrogène est récupéré par évaporation, puis absorbé dans de l'eau.