Hydrure de sodium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Hydrure de sodium | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| Apparence | cristaux cubiques blancs à gris ou aiguilles argentées | ||
| Propriétés chimiques | |||
| Formule brute | NaH | ||
| Masse molaire | 23,99771 ± 7,0E-5 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | décomposition à 425 °C | ||
| Solubilité | explose dans l'eau réagit violemment avec l'éthanol s'enflamme dans l'air humide soluble dans NaOH fondu | ||
| Masse volumique | 1,39 g·cm-3 | ||
| Cristallographie | |||
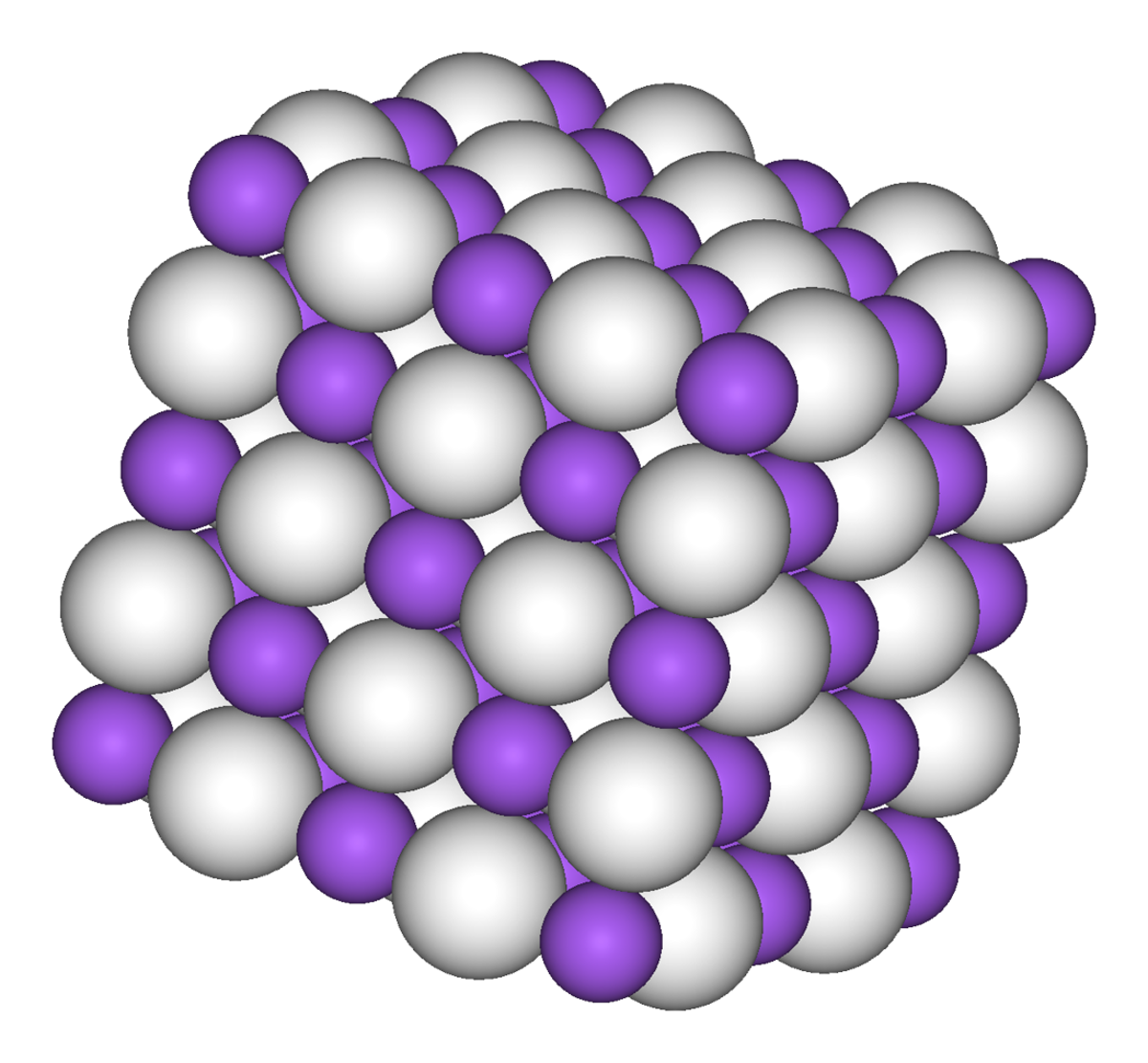
| Structure type | NaCl | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 15, | |||
| Phrases S : (2), 7/8, 24/25, 43, | |||
| | |||
| |||
| | |||
|
3 3 2 | |||
| | |||

Danger | |||
| | |||
L'hydrure de sodium est un composé chimique de formule NaH. Il est surtout utilisé comme base forte dans les réactions de synthèse organique. C'est un cristal ionique insoluble dans les solvants organiques (bien qu'il soit apparemment soluble dans le sodium fondu), ce qui s'explique par le fait que H- est un anion qui n'existe pas en solution. NaH réagit donc lorsqu'il se trouve à la surface d'un solide uniquement.
Propriétés et structure
NaH est produit par la réaction directe entre de l'hydrogène et du sodium liquide. L'hydrure de sodium est incolore, même si les échantillons semblent généralement gris. Tout comme l'hydrure de lithium LiH, l'hydrure de potassium KH et l'hydrure de rubidium RbH, il adopte la structure cristalline du NaCl. Dans ce motif, chaque cation Na+ est entouré par 6 anions H- dans une géométrie octaédrique.
Applications dans la synthèse organique
L'hydrure de sodium est très largement utilisé en chimie organique. Il est capable de capter un proton à un large éventail d'acides de Brønsted, même parmi les plus faibles, donnant les dérivés de sodium correspondants. Il est surtout employé pour déprotoner des acides carboxyliques et des analogues.



















































