Matériau à changement de phase (thermique) - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
On appelle matériau à changement de phase - ou MCP - tout matériau capable de changer d'état physique dans une plage de température restreinte. Cette plage est grossièrement située entre 10 et 80 degrés. Dans cet intervalle de température, le changement de phase prépondérant reste la fusion/solidification. Ces températures sont accessibles naturellement et sont omniprésentes dans notre vie quotidienne (température d'ambiance d'une maison, température d'un corps humain, de l'eau chaude sanitaire...)
Dans la suite de l'article, nous n'aborderons que les MCP dont le changement d'état se situe entre les phases liquides et solides.
Principe du changement de phase : chaleur sensible et chaleur latente
Tout matériau, solide ou liquide (ou gazeux) possède une capacité à stocker ou céder de l'énergie sous forme de chaleur. On distingue 2 types de transfert de chaleur (ou transfert thermique):
- Le transfert thermique par Chaleur Sensible (CS) : dans ce cas, le matériau en question peut céder ou stoker de l'énergie en voyant varier sa propre température, sans pour autant changer d'état. La grandeur utilisée pour quantifier la CS échangée par un matériau est la Chaleur Massique, notée Cp et exprimée en J/(kg.K). Exemple :
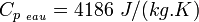
- Le transfert thermique par Chaleur Latente (CL) : dans ce cas, le matériau peut stocker ou céder de l'énergie par simple changement d'état, tout en conservant une température constante, celle du changement d'état. La grandeur utilisée pour quantifier la CL échangée par un matériau est la Chaleur Latente de Changement de Phase notée Lf (f pour fusion) pour un changement de phase Liquide/Solide, et Lv (v pour vaporisation) pour un changement de phase Liquide/Vapeur. Celle-ci est exprimée en J/kg. Exemple :
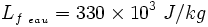
Exemples et types de matériaux à changement de phase
Il existe de nombreux types de matériaux à changement de phase, de nature physico-chimique très différentes les unes des autres. Ce sont leurs caractéristiques de fusion-cristallisation qui les rendent intéressants pour le stockage de chaleur latente. Parmi ces matériaux, on distingue les 3 grandes familles suivantes :
- Les composés minéraux (ou inorganiques). Parmi ces composés, seuls les sels hydratés présentent un intérêt pour leur utilisation en tant que MCP. Ils sont issus d'un alliage de sels organiques et d'eau. Ils ont l'avantage de posséder des grandes chaleurs latentes et des prix bas. En revanche, leur principal défaut concerne leur tendance à la surfusion.
- Les composés organiques. De propriétés thermiques (chaleur latente et conductivité thermique en particulier) moindre que les sels hydratés, ceux-ci présentent l'avantage de n'être pas ou très peu concernés par la surfusion. On utilise en particulier, pour le stockage de chaleur latente, les paraffines et les acides gras qui appartiennent à cette famille.
- Les composés eutectiques. Les eutectiques sont un mélange de sels possédant une température de fusion constante pour une valeur particulière de concentration. Ils peuvent être inorganiques et/ou organiques.
| Nom | Tfusion (°C) | Lf (kJ/kg) | Cpsolide (kJ/(kg.K)) | Cpliquide (kJ/(kg.K) | ρ solide (kg/m³) | ρ liquide (kg/m³) |
|---|---|---|---|---|---|---|
| Composés Organiques | ||||||
| Acide formique | 8,3 | 247 | ? | 0,099 | ? | 1220 |
| Acide acétique | 16,7 | 194 | ? | ? | 1266 | 1049 |
| Phénol | 40,8 | 120 | ? | ? | 1070 | ? |
| Acide dodécanoïque | 41-43 | 211,6 | 1,76 | 2,27 | 1007 | 862 |
| Acétate trihydrate de sodium | 55-58 | 242,85 | 3,31 à 30°C | 3,06 à 70°C | 1392 à 30°C | 1279 à 70°C |
| Hydroxyde de Sodium | 64,3 | 272,15 | 1,88 à 30°C | 2,18 à 70°C | 1720 à 30°C | 1670 à 70°C |
| Composés Inorganiques | ||||||
| H2O (Eau) | 0 | 330 | 2,06 à 0°C | 4,186 à 20°C | 998 à 20°C | 917 à 0°C |
| H2SO4 (Acide Sulfurique) | 10,4 | 100 | ? | ? | ? | 1838 |
| SO3 (Trioxyde de soufre) | 16,9 | 108 | ? | 0,024 | ? | 1920 |
| H3PO4 (Acide Phosphorique) | 26,0 | 147 | ? | ? | 1834 | 1685 |
| Ga (Gallium) | 29,8 | 80 | 0,370 | ? | 5904 | ? |