Alliage - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Un alliage est une combinaison d'un métal avec un ou plusieurs autres éléments chimiques.
Un métal pur a des caractéristiques mécaniques relativement faibles. Le fait d'ajouter d'autres éléments permet de « durcir » (augmenter les caractéristiques mécaniques).Ces ajouts permettent également de modifier les caractéristiques chimiques des métaux (en particulier leur comportement à la corrosion) ou d'améliorer d'autres caractéristiques (facilité de mise en œuvre : coulabilité par exemple).
Le métal principal, la plus importante partie du mélange, est appelé « métal de base » ou « base ». Les éléments ajoutés volontairement sont appelés « éléments d'alliage » (ou d'addition) et les éléments non désirés sont appelés impuretés.
Les éléments d'alliages sont le plus souvent des métaux, mais peuvent également être d'autres éléments chimiques : le carbone dans l'acier ou la fonte, le silicium dans l'aluminium, etc.
Généralement, quand l'élément d'alliage n'est pas un métal, sa proportion reste faible. Ainsi, la concentration de carbone est inférieure à 2% en masse pour l'acier et inférieure à 7% en masse pour la fonte, alors qu'il est possible de faire un alliage cuivre zinc (laiton) avec 50% de chacun des éléments.
Un alliage peut être naturel, par exemple l'électrum, alliage d'or et d'argent natifs utilisé dans la Préhistoire et l'Antiquité : Varna, Asie Mineure, Ur, Égypte, etc.
Alliage binaire
Alliage binaire à une seule phase
Un alliage homogène est constitué d'une seule phase solide homogène. Pour obtenir un alliage homogène, il faut qu'il y ait miscibilité totale entre les éléments d'alliage. Il y a deux possibilités :
- Les deux éléments d'alliage sont solubles l'un dans l'autre quelles que soient leurs proportions respectives.
- La concentration de l'élément d'alliage est inférieure à la limite de solubilité.
Les règles de Hume-Rothery indiquent les conditions pour obtenir un alliage homogène avec solubilité totale à l'état solide.

| Élément | Rayon atomique | Structure cristalline |
|---|---|---|
| Bismuth | 160 pm | Rhomboédrique |
| Antimoine | 145 pm | Rhomboédrique |
Les alliages de bismuth et d'antimoine forment une solution solide (en dessous du solidus) dans tous les cas de figure et à toutes les températures. Le diagramme de phase est un diagramme à un fuseau.
Quelques autres couples dont la miscibilité est bonne et permet d’obtenir des solutions solides homogènes à toutes températures : cuivre-nickel, cuivre-palladium, Argent-or, argent-palladium, molybdène-vanadium, molydène-tungstène, etc.
Certains alliages binaires solubles présentent aux plus basses températures un défaut de solubilité. Il apparaît sur le diagramme de phase un secteur où cohabitent deux phases, la première étant constituée d'une solution solide saturée de B dans A, la deuxième inversement de A dans B. C'est le cas par exemple du système cuivre-nickel qui présente en dessous de 322 °C une zone avec deux phases 1 et 2.
Alliage binaire à plusieurs phases
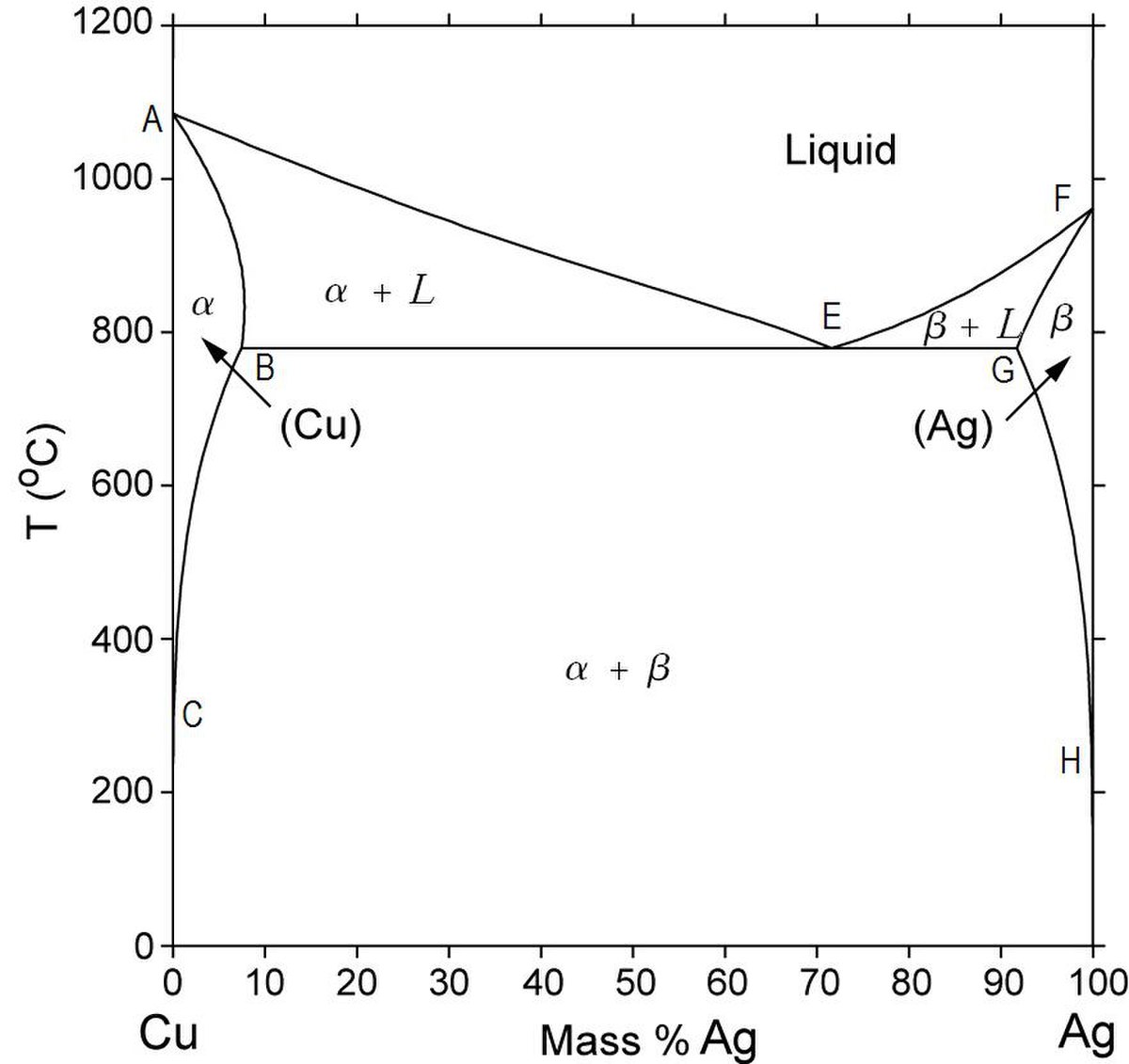
Un autre type de diagramme de phase binaire commun et relativement simple trouvé pour les alliages est un diagramme de phase binaire eutectique. Un certain nombre de caractéristiques de ce diagramme de phase est important et mérite d'être signalé. Tout d'abord, trois régions monophasées sont visibles sur le schéma: α, β et liquide. Sur la figure à gauche, la phase α est une solution solide riche en cuivre, qui a pour soluté l'argent et présente une maille CFC (cubique à faces centrées). La phase β (solution solide) a aussi une structure CFC, mais le cuivre est le soluté.
Ainsi, la solubilité dans chacune de ces phases solides est limitée, en ce que, à tout température en dessous de la ligne BEG, la concentration d'argent qui peut se dissoudre dans le cuivre (pour la phase α) est limitée, et de même façon pour le cuivre en argent (pour la phase β). Le limite de solubilité de la phase α correspond à la ligne de démarcation, marquée CBA.
À des températures inférieures à 779°C (1434°F), la ligne de limite de solubilité solide qui sépare la phase α et la phase α + β régions est appelé une ligne Solvus, la frontière entre le champ α et le champ α + L est la ligne de solidus (AB). Pour la phase β, deux lignes de solidus et Solvus existent également, HG et GF, respectivement. La ligne horizontale BEG, qui est parallèle à l'axe de composition et s'étend entre le maximum de solubilité de ces positions, peut aussi être considérée comme une ligne solidus, elle représente la température la plus basse à laquelle une phase liquide peut exister pour tout alliage de cuivre-argent qui est à l'équilibre.
Il y a aussi trois régions de deux phases trouvées dans le système cuivre-argent. Comme l'argent est ajouté au cuivre, la température à laquelle les alliages deviennent totalement liquides diminue au long de la ligne liquidus (ligne AE); ainsi, la température de fusion du cuivre est réduit par l'ajout d'argent. C'est le même principe pour les alliages dont le composé majoritaire est l'argent: l'introduction de cuivre réduit la température de fusion complète au long de la ligne liquidus FE. Ces lignes liquidus répondent au point E sur le diagramme de phase, par le biais de qui passe également la ligne horizontale isotherme BEG. Point E est le point eutectique, qui est désigné par la composition CE et de la température TE; pour la système cuivre-argent, les valeurs de la CE et TE sont 71,9 wt% Ag et 779°C (1434°F), respectivement.
Une importante réaction a lieu dans un alliage de composition «CE» cependant elle change la température en passant par TE. Sur le refroidissement, une phase liquide est transformé en deux phases solides (α et β) à la température TE, la réaction inverse se produit sur le échauffement . C'est ce qu'on appelle une réaction eutectique (eutectic signifie facilement fondu), et CE et TE représentent les composition et température eutectiques, respectivement. Souvent, la ligne solidus horizontale à TE est appelé isotherme eutectique. La réaction eutectique, sur le refroidissement, est similaire à la solidification des composants purs en ce que la réaction à terme à une température constante, ou isométriquement, à TE. Toutefois, le produit solide de la solidification eutectique est toujours deux phases solides, alors que pour un simple composant, une seule phase se forme. A cause de cette réaction eutectique, les diagrammes de phase similaires à ceux de la figure du diagramme Ag-Cu sont qualifiées de diagrammes de phase eutectiques.
Dans la construction de diagrammes de phases binaires, il est important de comprendre que un ou au maximum deux phases peuvent être en équilibre dans une région de phase. Pour un système eutectique, trois phases (α, β et L) peuvent être en équilibre, mais seulement à points au long de la ligne eutectique.
Il y a des milliers de combinaisons possibles pour diagrammes de phases avec plusieurs phases. Certaines des principales caractéristiques des diagrammes de phases comprennent points congrus, où une phase solide se transforme directement en liquide. Il y a aussi le peritectoid, un point où les une solide se trasnforme en une phase liquide et une autre phase solide lors du chauffage. L'inverse de cela, lorsque un phase solide se transforme en deux phases solides au cours de chauffage, est appelé le eutectoïdes.
Un diagramme de phase complexe d'une grande importance technologique est celle de la fer-carbone système de moins de 7% de carbone.
L'axe des X d'un tel schéma correspond à la concentration variable du mélange. Comme les mélanges sont généralement loin d'affaiblir et leur densité en fonction de la température est généralement inconnu, la mesure préféré est concentration molaire. Un basé sur le volume de mesure comme molarité serait déconseillé.