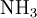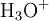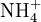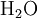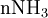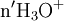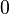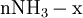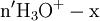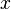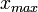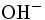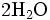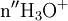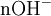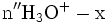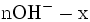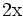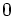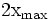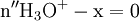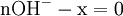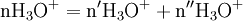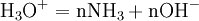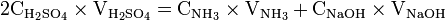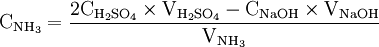Méthode de Kjeldahl - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
La méthode de Kjeldahl est applicable pour le dosage de l’azote de différents composés azotés tels les amines et les sels d’ammonium quaternaires. Elle ne permet pas le dosage direct des nitrates, nitrites, nitrosyles, cyanures qu’il faut d’abord réduire en ammoniac.
Quand l’azote est sous forme organique, il faut d’abord procéder à la minéralisation du composé pour passer à de l’azote minéral. On détruit la molécule organique en l’oxydant à ébullition par H2SO4 concentré, en présence de catalyseur : le carbone s'élimine sous forme de CO2, l’hydrogène sous forme de H2O et l’azote reste en solution sous forme de
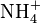
Historique
C'est en 1883 que Johan Kjeldahl mit au point cette méthode qui porte désormais son nom. La méthode Kjeldahl est une méthode universellement reconnue, adaptable à tous les types de matrices, sans nécessité de calibration ou d'étalonnage. La méthode Kjeldahl est la méthode de référence de détermination des protéines.
Exemple : dosage de l'azote total du lait
Le lait contient entre 32 et 35 g/L de matière organique azotée dont 95% de l'azote se trouve dans les protéines et les 5% restant dans des acides aminés libres.
Mode opératoire
Minéralisation
Pour doser les protéines contenues dans du lait par cette méthode, il faut d'abord procéder à une minéralisation. Pour cela introduire dans un matras :
- 2 mL de lait exactement mesuré ;
- 15 à 20 mL d'acide sulfurique concentré ;
- 6 g de sulfate de potassium ;
- 1 g de sulfate de cuivre ;
- quelques grains de pierre ponce.
Porter à ébullition la solution sous une hotte ventilée (les vapeurs de la minéralisation sont très irritantes et toxiques). Puis, à partir de l'éclaircissement de la solution, prolonger l'ébullition une demi-heure.
Laisser refroidir et introduire avec précaution de 30 à 50 mL d'eau distillée. Attention à l'ajout de l'eau distillée car l'ajout d'eau dans un acide fort comme l'acide sulfurique ici peut engendrer une très forte réaction, voir l'explosion !
Récupération de l'ammoniac
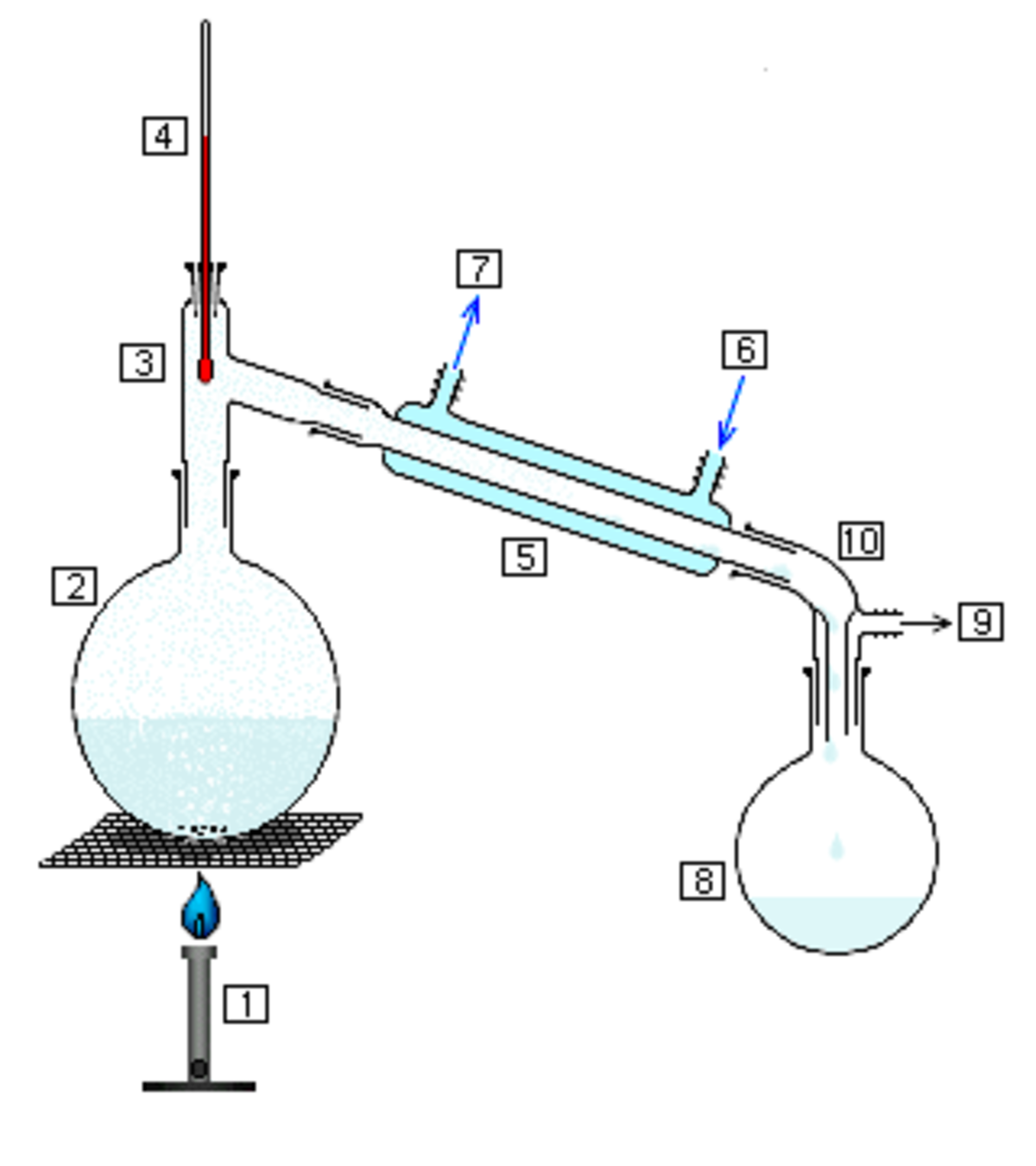
Réaliser le montage de distillation suivant :
Dans le ballon, introduire :
- le contenu du matras (voir ci-dessus) soigneusement rincé (pour en extraire tous les composés azotés ; compléter à 250 mL avec de l'eau distillée ;
- quelques gouttes de phénolphtaléine ;
- de l'hydroxyde de sodium à 400 g/L jusqu'à ce que le contenu du ballon devienne rose.
Plonger le bout du réfrigérant dans un bécher contenant 20 mL d'acide borique et 2-3 gouttes de rouge de méthyle.
Chauffer modérément le ballon.
Doser l'ammoniac, au fur et à mesure de son dégagement, par une solution titrée d'acide sulfurique à 0 05 mol/L. Le dosage est terminé dès que la coloration reste stable pendant environ 5 min.
Par précaution, retirer le bécher avant de stopper le chauffage pour éviter tout siphonnage.
Calculs
x représente l'avancement de la réaction. Dans la première réaction, l'ammoniac est mis en présence d'un excès d'acide où une partie n' de l'acide réagit. On fait réagir le restant de l'acide n avec la soude. nH3O + = n' + n'', c'est un dosage en retour.
|
|
|
|
|
| |
|---|---|---|---|---|---|
| Etat initial |
|
|
| excès | |
| État intermédiaire |
|
|
| excès | |
| État Final |
|
|
| excès |
-
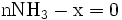
-
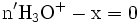
- donc
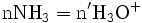
|
|
|
|
| |
|---|---|---|---|---|
| État initial |
|
|
| |
| État intermédiaire |
|
|
| |
| État Final |
|
|
|
donc
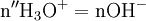
Une mole de NH provient d'une mole d'atomes d'azote (N). Donc en retrouvant le nombre de moles d'atomes d'azote vous pourrez en déterminer la concentration massique.