Organogel - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Un organogel est un gel physique, c'est un matériau solide, non cristallin et non vitreux composé d'un liquide organique piégé dans un réseau tridimensionnel complexe. Le liquide peut être, par exemple, un sovant organique, une huile minérale ou une huile végétale. La solubilité, la morphologie et les dimensions des structures formant le réseau sont des caractéristiques importantes à l'égard des propriétés physiques de l'organogel. Souvent, ces systèmes sont basés sur l'auto-assemblage supramoléculaire de petites molécules organiques : les organogélateurs, en des structures généralement fibrillaires. Ces objets ont une longueur de l’ordre du micron et une section de l’ordre de la dizaine de nanomètres.
Ces gels se forment pour des concentrations de quelques pourcents en masse en organogélateur et sont thermoréversibles. Leur viscosité est supérieure de 6 à 10 ordres de grandeur par rapport à celle du solvant seul et ils présentent généralement un comportement rhéofluidifiant : leur viscosité diminue sous l’effet d’un cisaillement. De par ces propriétés, les organogels sont utilisés dans des domaines aussi nombreux que variés tels que la pharmaceutique, la cosmétique, la conservation d'oeuvres d'art, et l'alimentation. Un exemple de formation indésirée de tels gels est la cristallisation du pétrole en cire.
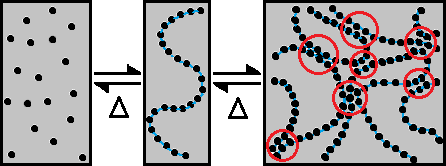
Formation d'un organogel
Un organogel est préparé généralement en chauffant un organogélateur dans un liquide organique jusqu'à dissolution totale du solide, puis en laissant refroidir la solution (sol) en dessous de la température de gélation : transition sol-gel. C'est à dire la température en dessous de laquelle le matériau ne coule plus même à des temps longs. Le matériau résultant est un gel plus ou moins pâteux ; la description formelle et la classification de ces gels est basée sur leurs propriétés rhéologiques. Les agrégats colloïdaux (dont les dimensions typiques sont comprises entre 2 et 200 nm) dans le gel sont liés dans des réseaux tridimensionnels complexes qui immobilisent le liquide organique sur une étendue variable grâce principalement à la tension de surface. Malgré les nombreuses études présentes et passées sur ce phénomène, plusieurs questions importantes restent sans réponse. Sous quelles conditions une molécule est un organogélateur ? Quelle est la relation, s'il y en a une, entre l'empilement des molécules à l'état cristallin et leurs divers agrégats dans l'état de gel ? Quelle est l'influence des auto-assemblages supramoléculaires des organogélateurs sur les propriétés thermodynamiques, mécaniques, optiques... des gels ? Toutes ces questions sont tournées vers un unique objectif pratique : comment prévoir si et sous quelles conditions un organogel se forme. Le moyen le plus efficace pour une petite quantité de gélateur d'immobiliser une grande quantité de liquide est d'adopter une structure fibrillaire. La structure des agrégats linéaire dans le gel est déterminée par la direction et la force des liaisons associées au processus d'agrégation. Alors que dans l'eau, les attractions hydrophobes jouent un rôle majeur dans la formation des agrégats (micelles...), elles ne sont plus significatives lorsqu'on se trouve en solvant organique, l'agrégation dans les organogels résulte d'autres interactions.

















































