Organogel - Définition
La liste des auteurs de cet article est disponible ici.
Interactions moléculaires
Les organogélateurs sont capables de gélifier toute sorte de solvants organiques même à des concentrations massiques relativement faibles (moins de 1% en masse). Pour qu’une aussi petite quantité de molécules puisse former le gel, l’enthalpie des interactions entre organogélateurs doit être assez stabilisante pour balancer la diminution de l’entropie qui accompagne la réduction des degrés de liberté du système. Dans les liquides organiques les forces attractives sont principalement les interactions dipolaires et, si les organogélateurs le permettent, peuvent rentrer en jeu les forces de Van der Waals, les interactions π, les forces solvophobes, ainsi que les liaisons hydrogène intra ou intermoléculaires.
Un groupe important d’organogélateurs utilise les liaisons H comme force motrice de l’auto-assemblage supramoléculaire ; en font partie les amides, les urées, les dérivés peptidiques, les pepsipeptides ou les structures peptidomimétiques, sucres et alcools. Ces molécules peuvent être vues comme des systèmes à deux acteurs : une partie donneuse de liaisons H responsable de la cohésion de la supra-structure et une partie qui favorise la solubilité de la molécule et l’unidirectionnalité des liaisons, et empêche sa cristallisation. Cependant une molécule possédant un ou plusieurs groupements amide n’est pas obligatoirement un organogélateur et inversement, d’autres interactions peuvent entrer en jeu comme il a été dit plus haut. C’est le cas par exemple des stéroïdes, cholestérol et dérivés, dérivés aromatiques, et même des molécules plus simples telles que des alcanes ou alcanes semi-fluorés.
Malgré ces assertions il est toujours très difficile de prévoir si une molécule est un organogélateur et quel liquide organique elle peut gélifier, pour cause, l’absence à ce jour de relation structure/activité. Des variations très subtiles de la structure d’un gélateur peuvent se traduire par un changement drastique de ses propriétés gélifiantes ou de la stabilité du gel. Des organogélateurs sont découverts continuellement mais sont souvent le fruit du hasard, ils n’en sont pas moins très nombreux et leur nombre croît d’année en année.
Domaines d'application
Les organogélateurs sont tout d’abords utilisés pour leurs propriétés rhéomodifiantes dans des domaines aussi nombreux que variés tels que la peinture, la cosmétique, l’alimentaire, la pharmacologie, les lubrifiants ou les explosifs. Un autre type d’application tire avantage de leur état de dispersion et leur microstructure en général. Ils sont utilisés comme agents clarifiants et nucléants de polymères, en catalyse, et peuvent également servir de gabarit pour élaborer des matériaux mésoporeux. Une autre application d’actualité est la récupération de pétrole en cas de fuite par condensation de ses hydrocarbures en boulettes d’une trentaine de centimètres de circonférence.
Les classes d'organogélateurs
Il n'est pas encore possible d'établir à priori si telle molécule va gélifier tel solvant. Les organogélateurs existant ont été découverts, pour la plupart, de manière fortuite. Ils ont été néanmoins séparés en plusieurs groupes caractéristiques.
Les dérivés d'acides gras
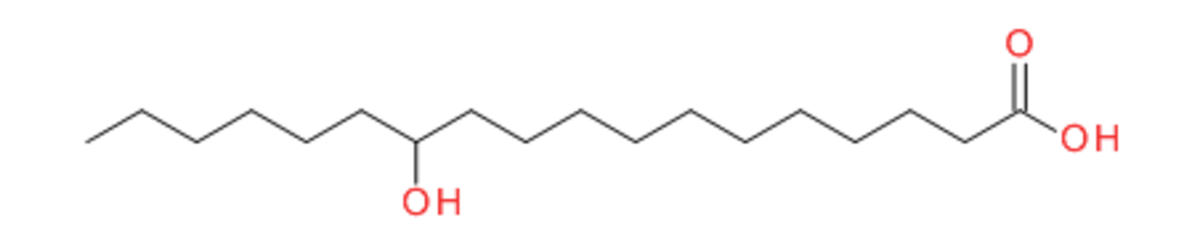
De nombreux dérivés d'acides gras tels que l'acide 12-hydroxyoctadecanoïque (ou acide 12-hydroxystéarique) et ses sels correspondants sont connus pour créer des matériaux solides à partir de liquides organiques. Des dispersion semi-solides de stéarate de lithium dans l'huile sont utilisées depuis des décennies dans l'industrie des lubrifiants. Dans les graisses lubrifiantes, le réseau 3D formé par les agrégats de ces molécules agit comme une éponge, maintenant le composant lubrifiant : l'huile, au contact des régions de friction entre surfaces métalliques dans les systèmes mécaniques. L'ensemble de liquides organiques pouvant être gélifiés par cette famille d'organogélateurs est très vaste, il s'étend des alcanes, tétrachlorométhane et solvants aromatiques à des fluides plus polaires tels que le nitrobenzène. La cinétique de la transition sol-gel montre un début net du module d'élasticité. G' et G" sont virtuellement indépendant de la fréquence de sollicitation et l'amplitude de G' est grande (3700 Pa à C~0,35%). La présence d'un centre stéréogène, ce qui est le cas dans l'acide stéarique et les sels correspondants, induit des agrégats chiraux ce qui n'est pas forcément le cas dans la phase cristalline. Les techniques de dichroïsme circulaire montrent en effet une réflexion préférentielle de la lumière polarisée ce qui est relié à la chiralité des fibres. En général, l'arrangement moléculaire des gélateurs dans les fibres du gel et dans les phases cristallines ne doit pas être considéré comme identique.