Peroxyde de sodium - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
| Peroxyde de sodium | |||
|---|---|---|---|
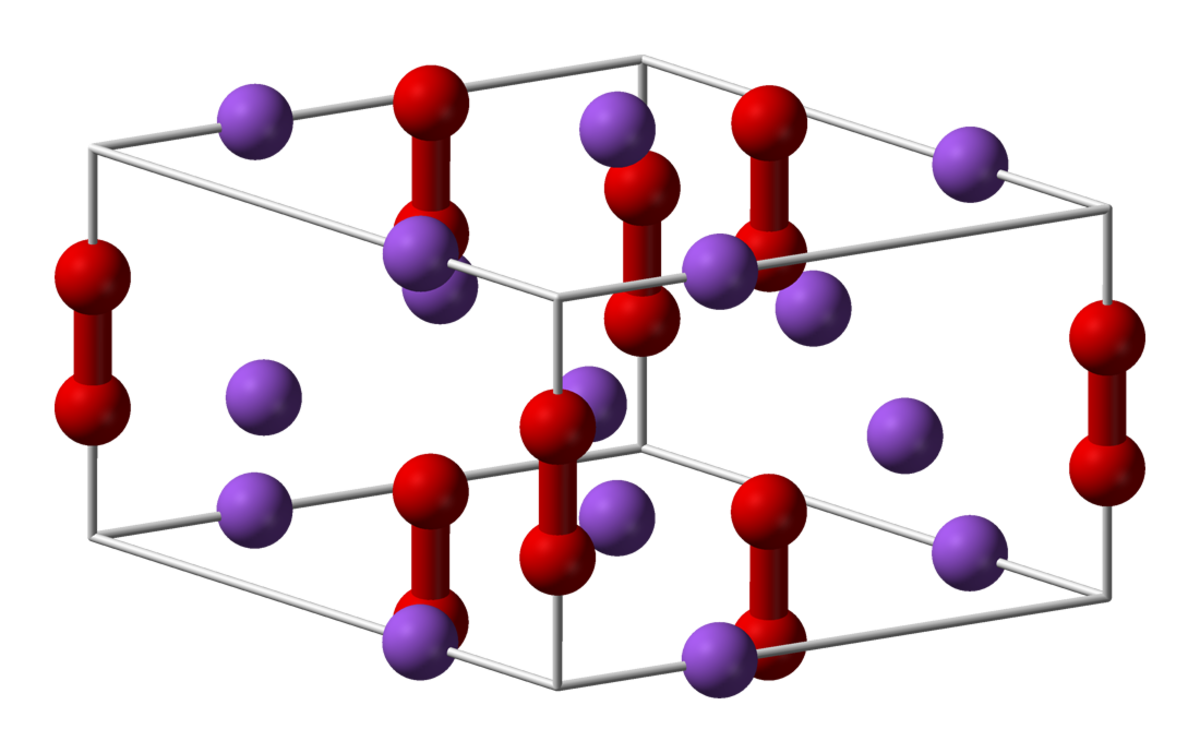
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| SMILES | |||
| InChI | |||
| Apparence | poudre blanche à jaune | ||
| Propriétés chimiques | |||
| Formule brute | Na2O2 | ||
| Masse molaire | 77,9783 ± 0,0006 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 675 °C | ||
| Masse volumique | 2,8 g·cm-3 | ||
| Point d’éclair | non inflammable | ||
| Thermochimie | |||
| S0 | 95 J K-1 mol-1 | ||
| ΔH0 | -513 kJ mol-1 | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 8, 35, | |||
| Phrases S : (1/2), 8, 27, 39, 45, | |||
| | |||
| |||
| | |||
|
0 3 1 OX | |||
| | |||


Danger | |||
| | |||
Le peroxyde de sodium est un composé de formule Na2O2. C'est un comburant comme tous les peroxydes. Il se forme en même temps que l'oxyde lors de la combustion du sodium dans l'air.
Il réagit avec l'eau pour donner du peroxyde d'hydrogène et de l'hydroxyde de sodium. Il était distribué en France sous le nom commercial d’oxylithe.




















































