Protéine fluorescente verte - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
La protéine fluorescente verte (souvent abrégé GFP, de l'anglais « Green Fluorescent Protein ») est une protéine ayant la propriété d'émettre une fluorescence de couleur verte. Issue d'une méduse (Aequorea victoria), cette protéine est intrinsèquement fluorescente. Son gène peut être fusionné in-vitro au gène d'une protéine que l'on souhaite étudier. Le gène recombinant est ensuite réintroduit dans des cellules ou un embryon, qui va alors synthétiser la protéine de fusion, alors fluorescente. On pourra alors l'observer à l'aide d'un microscope à fluorescence, par exemple. Cette méthode permet d'étudier les protéines dans leur environnement naturel : la cellule vivante. La découverte et les applications de la GFP ont été couronnées par le prix Nobel de chimie décerné à Osamu Shimomura, Martin Chalfie et Roger Tsien le 8 octobre 2008.
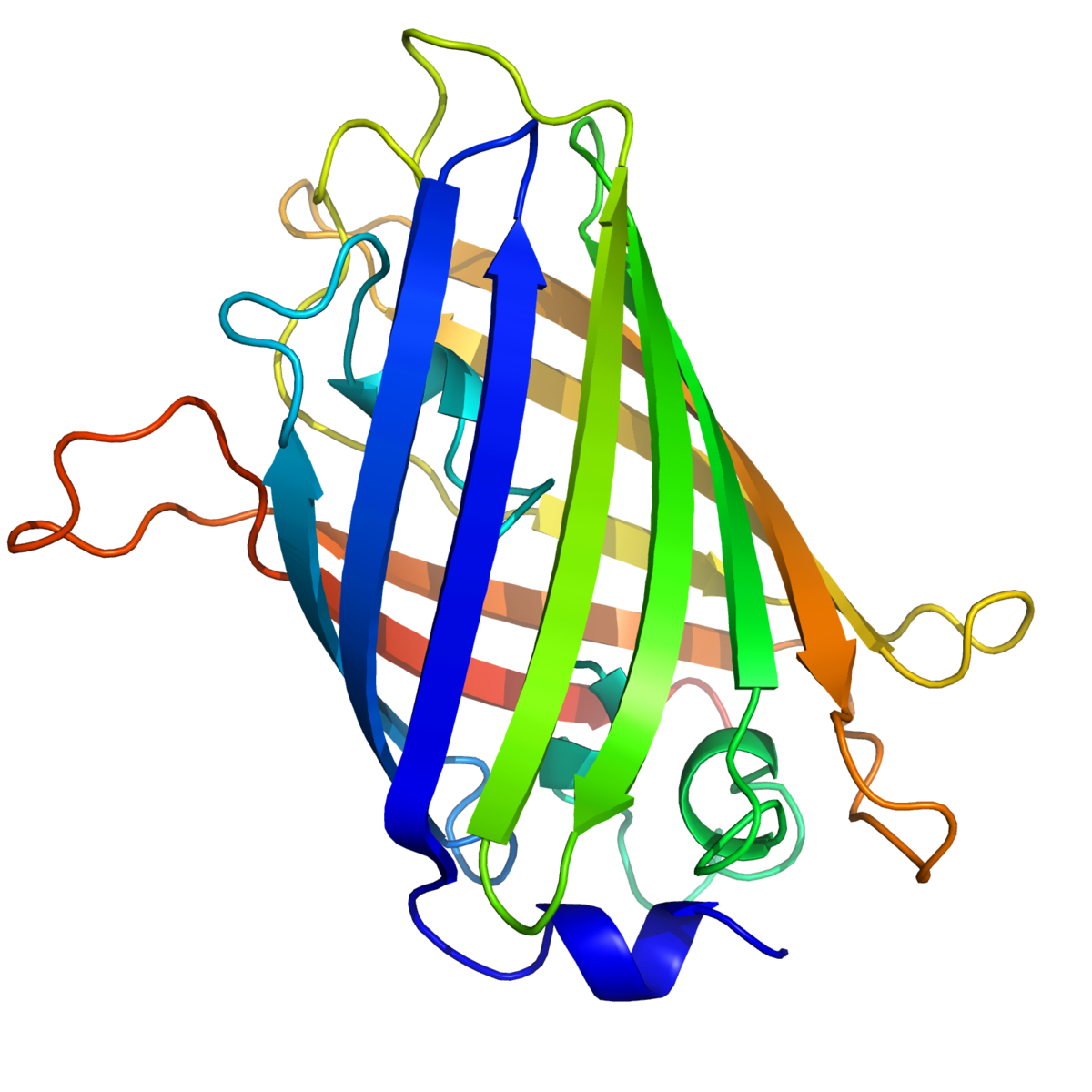
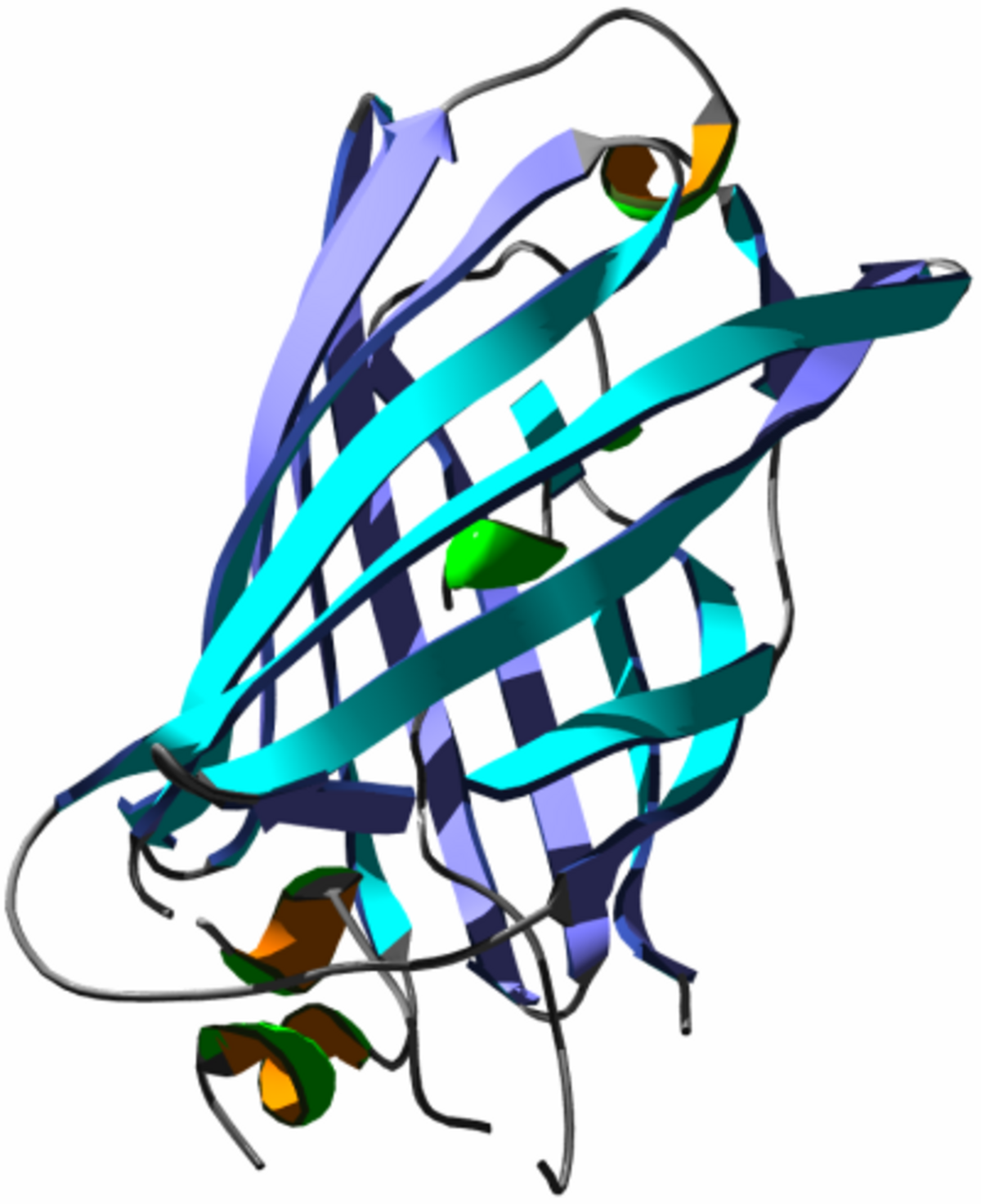
Structure de la GFP
La GFP a été décrite pour la première fois en 1962. Elle est constituée de 238 acides aminés pour une masse moléculaire d'environ 27 kDa. Le chromophore (centre actif responsable de la fluorescence) est constitué par les chaînes latérales d'une glycine, une tyrosine et une sérine.
La GFP non modifiée, dite sauvage (wild type : wGFP) a deux maxima d'excitation. Le premier se trouve avec une longueur d'onde de 395 nm (lumière UV), le deuxième à 475 nm (lumière bleue). La longueur d'onde d'émission maximale est à 504 nm. Elle est également photoexcitable, ce qui signifie que l'intensité de la fluorescence émise est intensifiée par une exposition à des photons ultraviolets, caractéristique perdue dans la plupart des variants produits par la suite.
Il existe maintenant différentes variantes de la GFP qui ont été obtenues en modifiant celle-ci par ingénierie génétique. Il existe également d'autre protéines fluorescentes issues d'autre organismes que A. Victoria :
- eGFP : fluorescence verte ("enhanced GFP")
- eCFP : fluorescence cyan (bleu-vert), et son variant Cerulean
- eYFP : fluorescence jaune (Y pour yellow), et ses variants Venus et Citrine.
- eBFP : "Blue fluorescent protein" et un variant : l'Azurite.
- PA-GFP : GFP photoactivable à 405 nm
- PHluorin : GFP sensible au pH, s'éteint à pH acide.
Il a été montré que la GFP fusionnée à une protéine peut aider le repliement de cette dernière lors de son expression génétique.
Sources et références
- Chimie : Le Nobel de la méduse fluo dans Libération du 8 octobre 2008.
- Prix Nobel de Chimie 2008 : une méduse fluorescente récompensée Un article Ecole Normale Supérieure - DGESCO
- Nature Biotechnology - 24, 1569 - 1571 (2006)
- Nature Biotechnology 24, 577 - 581 (2006)
- Nature Biotechnology 22, 1524 - 1525 (2004)