Chlorure d'or(III) - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Chlorure d'or(III) | ||
|---|---|---|

| ||
| Général | ||
| Nom IUPAC | ||
| Synonymes | Chlorure aurique Trichlorure d'or | |
| No CAS | ||
| No EINECS | ||
| No RTECS | (anhydre) | |
| Apparence | Solide cristallin rouge | |
| Propriétés chimiques | ||
| Formule brute | AuCl3 (sous forme Au2Cl6) | |
| Masse molaire | 303,326 ± 0,006 g·mol-1 | |
| Propriétés physiques | ||
| T° fusion | 253,85 °C (décomposition) | |
| Solubilité | 680 g·l-1 (eau froide). Soluble dans l'éthanol et le diéthyl éther | |
| Masse volumique | 3,9 g·cm-3 (20 °C, solide | |
| Susceptibilité magnétique | -0,000112 cm³/mol | |
| Thermochimie | ||
| ΔH0 | −118 kJ/mol | |
| Cristallographie | ||
| Structure type | monoclinique | |
| Coordinence | plan carré | |
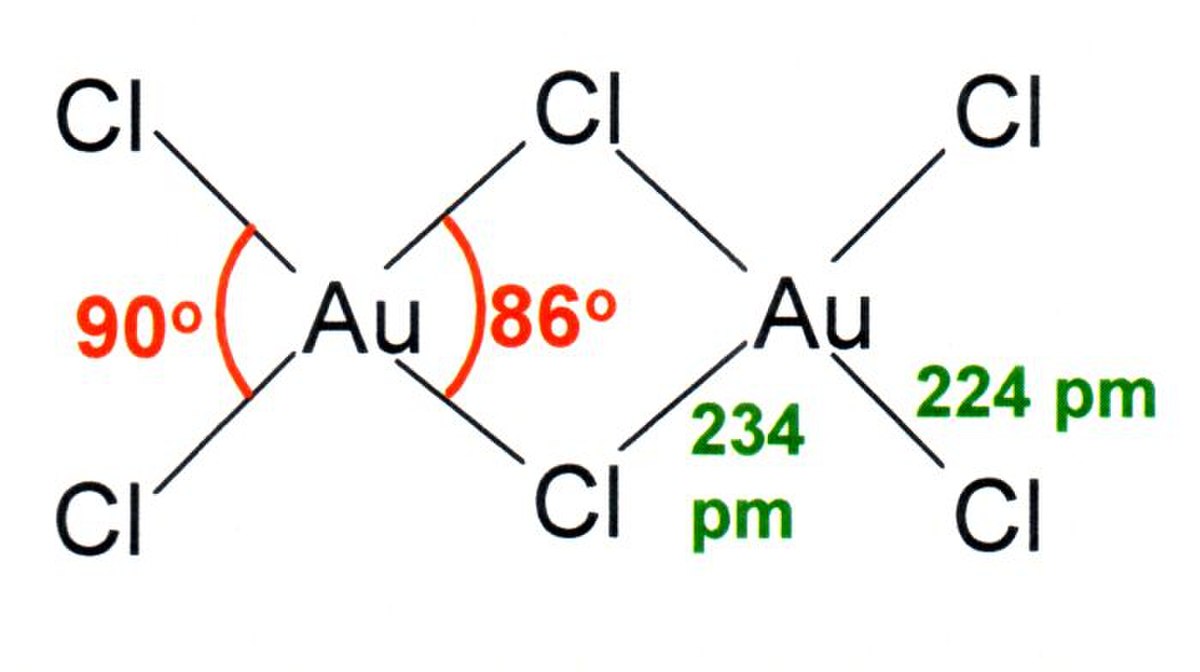
| Distance interatomique | 224 pm (Au - Cl externe) 234 pm (Au - Cl pontant) | |
| Angle de liaison | 90 ° (Au - Cl externe) 86 ° (Au - Cl pontant) | |
| Précautions | ||
| | ||
| ||
| Phrases R : 36/37/38, | ||
| Phrases S : 26, 36, | ||
| | ||
|
0 1 0 {estimation) | ||
| Composés apparentés | ||
| Cations apparentés | Chlorure d'or(I) Chlorure d'argent Chlorure de platine(II) Chlorure de mercure(II) | |
| Anions apparentés | Fluorure d'or(III) Bromure d'or(III) | |
| | ||
Le chlorure d'or(III), appelé habituellement chlorure aurique, et l'un des composés les plus communs de l'or. Sa formule est AuCl3. Le chiffre romain dans son nom indique que l'or est à un état d'oxydation de +3, ce qui est la forme la plus stable de l'or dans ses composés. L'or forme également d'autres chlorures comme le chlorure d'or(I) (AuCl), moins stable que AuCl3. L'acide chloraurique, (HAuCl4), produit formé lors de la dissolution de l'or dans de l'eau régale, est aussi parfois référé comme « chlorure d'or », « acide de chlorure d'or(III) » ou encore « hydrate de chlorure d'or(III) ».
Le chlorure d'or(III) est très hygroscopique et soluble dans l'eau et l'éthanol. Il se décompose au-dessus de 160 °C (433 K) ou à la lumière, et forme une gamme de complexes avec de nombreux ligands.
Structure
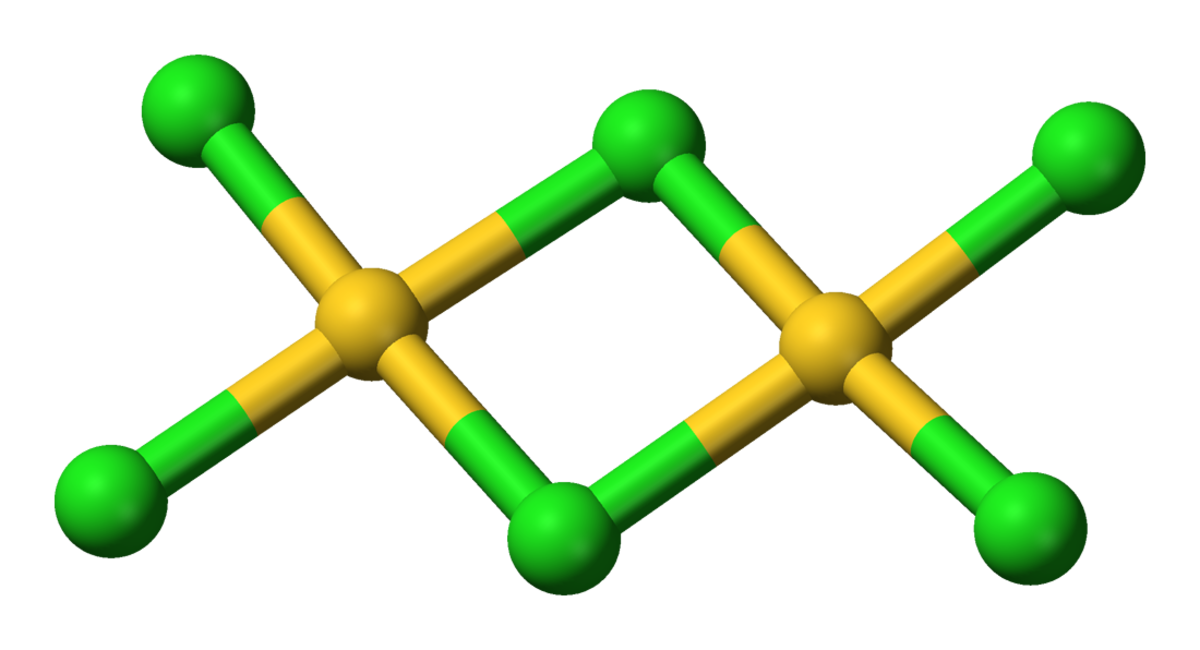
AuCl3 existe sous une forme de dimère, tant en phase solide que gazeuse; le bromure AuBr3 obéit au même schéma. Chaque Au central est plan carré. Cette structure est une réminiscence des structures biquadratiques adoptées par AlCl3 et FeCl3. Les liaisons dans AuCl3 sont principalement covalentes, ce qui reflète l'état d'oxydation élevé et l'électronégativité relativement élevée (pour un métal) de l'or.
Préparation
Le chlorure d'or(III) est la plupart du temps préparé par chloration directe du métal à hautes températures :
- 2 Au + 3 Cl2 → 2 AuCl3
Propriétés chimiques
L'AuCl3 anhydre commence à se décomposer en AuCl à environ 160 °C; cependant, cette réaction s'inverse par dismutation à de plus hautes températures pour redonner de l'or métallique et AuCl3.
- AuCl3 → AuCl + Cl2 (>160 °C)
- 3 AuCl → AuCl3 + 2 Au (>420 °C)
AuCl3 est un acide de Lewis qui forme facilement des complexes. Ainsi, avec l'acide chlorhydrique, l'acide chloraurique HAuCl4) est formé :
- HClaq + AuCl3(aq) → H+AuCl4-(aq)
Les chlorures ioniques comme le KCl forment des ions AuCl4- avec AuCl3.
Les solutions aqueuses de AuCl3 réagissent avec des alcali comme l'hydroxyde de sodium pour former un précipité de Au(OH)3 impur, qui se dissoudra dans du NaOH pour former de l'aurate de sodium NaAuO2). S'il est chauffé doucement, Au(OH)3 se décompose en oxyde d'or(III) (Au2O3) puis en or métallique.