Acide chloraurique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acide chloraurique | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | acide aurique chlorhydrate du trichlorure d'or | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | cristal hygroscopique en forme d'aiguilles, jaune citron | ||
| Propriétés chimiques | |||
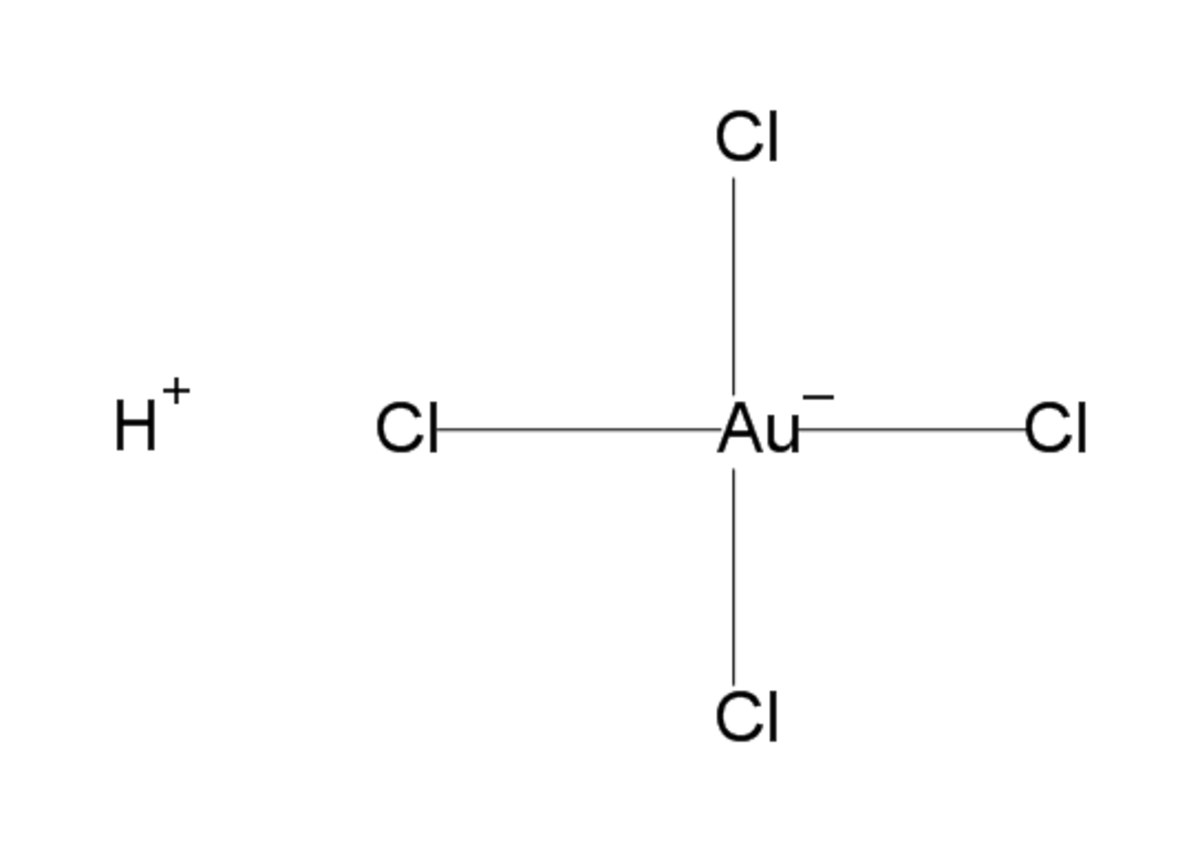
| Formule brute | HAuCl4 | ||
| Masse molaire | 339,787 ± 0,008 g·mol-1 | ||
| pKa | acide fort | ||
| Propriétés physiques | |||
| T° fusion | 30 °C (trihydrate) | ||
| T° ébullition | 200 °C (décomposition) | ||
| Solubilité | 150 g·l-1 (eau, 20 °C, trihydrate) | ||
| Masse volumique | 3,9 g·cm-3 (trihydrate, 20 °C) | ||
| T° d’auto-inflammation | non-combustible | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 34, 43, | |||
| Phrases S : 26, 36/37/39, 45, | |||
| | |||
| |||
| | |||
L'acide chloraurique ou acide tétrachloraurique est un composé inorganique de formule HAuCl4, et est donc principalement constitué d'or et de chlore. Il est avant tout utilisé comme précurseur de l'or.
Production et synthèse
La préparation la plus simple de l'acide chloraurique est la dissolution de l'or dans l'eau régale (mélange d'acide chlorhydrique et d'acide nitrique, une des rares solutions à pouvoir dissoudre l'or).
Un autre méthode consiste à faire réagir le chlorure d'or(III) avec l'acide chlorhydrique :
Utilisation
L'acide chloraurique est utilisé comme électrolyte dans le procédé Wohlwill de raffinage de l'or.
Comme le sel le plus commun de l'or, le chlorure d'or(III), il a de nombreuses applications de niche et est largement étudié dans la recherche. Il est par exemple, assez rarement, utilisé pour déposer des particules d'or sous la peau dans l'art corporel. Il est aussi utilisé en photographie comme bain de virage, pour donner une teinte dorée à la photo.
L'or colloïdal et les nanoparticules d'or sont produites en général dans une solution (« méthodes chimiques liquides ») par réduction de l'acide chloraurique par le sulfure de sodium, bien que des méthodes alternatives existent, comme la réaction de Norrish.
Propriétés physico-chimiques
L'acide chloraurique cristallise en longues aiguilles jaune citron, qui se dissolvent facilement dans l'eau ou l'éthanol Dans l'eau, l'acide chloraurique, qui perd son proton, a une géométrie de type carré plan (AX4E2). Il est un précurseur d'autres complexes aurifères.



















































