Eau régale - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Eau régale | |||
|---|---|---|---|

| |||
| Général | |||
| Synonymes | aqua regia, eau royale | ||
| No CAS | |||
| SMILES | |||
| InChI | |||
| Apparence | liquide jaune à rouge-brun | ||
| Propriétés chimiques | |||
| Formule brute | HNO3 + 3 HCl | ||
| Propriétés physiques | |||
| T° fusion | -42 °C | ||
| T° ébullition | 108 °C | ||
| Solubilité | miscible avec l’eau | ||
| Masse volumique | 1,01 g·cm-3 à 1,21 g·cm-3 | ||
| Pression de vapeur saturante | 21 mbar (20 °C) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 8, 35, | |||
| Phrases S : 23, 26, 36, 45, | |||
| | |||
| |||
| | |||
L’eau régale (latin, aqua regia, eau royale) est un mélange d’acide chlorhydrique et d’acide nitrique concentrés (2 ou 3 volumes d’acide chlorhydrique pour 1 d’acide nitrique) capable de dissoudre certains métaux nobles tels le platine, l'or ou le tantale insolubles dans ces acides seuls ou, tout autre acide simple concentré. C'est pourquoi cette solution est aussi connue sous le nom « d'eau royale ».
Applications
L'eau régale est avant tout utilisée dans la production d'acide chloraurique, l'électrolyte utilisé dans le procédé Wohlwill. Ce procédé est utilisé pour le raffinage d'or de très grande pureté (99,999%).
L'eau régale est aussi utilisée comme agent de gravure et pour certaines analyses chimiques. Elle est aussi utilisée dans certains laboratoires pour nettoyer la verrerie des composés organiques et des particules de métal. Cette méthode est d'ailleurs préférée pour le nettoyage des tubes RMN à la méthode « traditionnelle » du bain dans l'acide chromique, cette dernière pouvant laisser des traces de chrome pouvant perturber le spectre de l'analyse suivante. De plus les bains d'acides chromiques sont dangereux du fait de la haute toxicité du chrome et des risques d'explosion. Cependant l'eau régale est elle même très corrosive, et a été à l'origine de nombreuses explosions dues à de mauvaises manipulations.
Décomposition
L'eau régale n'est pas très stable, elle se décompose rapidement par formation de chlorure de nitrosyle et de chlore :
HNO3 (aq) + 3 HCl (aq)
Le chlorure de nitrosyle se décompose par la suite :
2 NOCl (g)
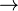
Les produits de ces réactions n'ont pas le pouvoir oxydant de l'acide nitrique, et donc avec le temps l'eau régale perd ses propriétés. Elle doit donc être préparée juste avant utilisation.
Fonctionnement
Chaque constituant de l'eau régale joue un rôle dans la dissolution de l'or.
L'acide nitrique est un puissant oxydant, mais pas assez pour permettre l'oxydation de quantité significative d'or :
Au(s) + 3NO3-(aq) + 6H+(aq) ⇔ Au3+(aq) + 3NO2(aq) + 3H2O(l)
Cette réaction est en effet un équilibre, qui n'est pas déplacé dans le sens de la formation de l'ion aurifère.
L'acide chlorhydrique fournit des ions chlorures ((Cl-)) qui permettent le déplacement de l'équilibre par la formation des anions chloraurates (AuCl4-) :
Au3+(aq) + 4Cl-(aq) ⇔ AuCl4 (aq)-
la réaction d'oxydation est donc :
Au(s) + 3NO3-(aq) + 6H+(aq) + 4Cl-(aq) ⇔ AuCl4 (aq)- + 3NO2(aq) + 3H2O(l)
La réaction avec le platine est un peu plus complexe, mais similaire. La réaction initiale produit un mélange d'acide chloroplateux (H2PtCl4) et de chlorure nitrosoplatinique ((NO)2PtCl4). Le chlorure nitrosoplatinique est un solide qui peut être redissout par lavage à l'acide chlorhydrique concentré.
- Pt (s) + 2 HNO3 (aq) + 4 HCl (aq)
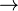
- (NO)2PtCl4 (s) + 2 HCl (aq)