Cyanotoxine - Définition
La liste des auteurs de cet article est disponible ici.
Toxicologie
Plusieurs voies d’exposition sont possibles pour entrer en contact avec les cyanotoxines. Principalement, on retrouve l’ingestion d’eau contaminée et le contact primaire avec cette même eau. On suspecte que l’inhalation possible des toxines sous formes d’aérosols et la consommation d’organisme, qui aurait bio-accumulé une toxine, sont des sources d’exposition plausibles.
Une panoplie d’étude toxicologique ont été effectuées pour déterminer les effets aigus, chroniques, cancérogènes et tératogènes des différentes cyanotoxines sur plusieurs organismes (majoritairement les souris) et selon plusieurs routes d’exposition.
Le tableau suivant présente des valeurs de DL50 chez la souris, obtenues par injection intra-péritonéale.
| Cyanotoxine | DL50 (ug/kg) |
|---|---|
| Microcystine-LR | 50 |
| Microcystine-LA | 50 |
| Microcystine-YR | 70 |
| Microcystine-RR | 600 |
| (D-Asp3) microcystine-LR | 50 à 300 |
| (D-Asp3) microcystine-RR | 250 |
| (Dha7) microcystine-LR | 250 |
| (6Z-Adda) microcystine-LR | > 1200 |
| Nodularine | 50 |
| Cylindrospermopsine (pure) | 2000 |
| Anatoxine-a et homoanatoxine-a | 200 à 250 |
| anatoxine-a(S) | 20 |
| Saxitoxine | 10 |
À titre de comparaison, la toxicité aigüe par gavage chez la souris est située entre et 5 et 10 mg/kg de masse corporel pour la microcystine-LR, les nodularines, les cylindrospermopsines et pour l’anatoxine-a. La saxitoxine (STX) présente des valeurs typiquement plus basses, soit près de 260 ug/kg chez la souris.
Le tableau suivant présente des valeurs de toxicité subchronique chez la souris où la DSENO est la dose sans effet nocif observé.
| Cyanotoxine | DSENO (ug/kg jour) |
|---|---|
| Microcystine-LR | 40 (souris, gavage, 13 semaines) |
| Cylindrospermopsine | 30 (souris, gavage, 11 semaines) |
| anatoxine-a | 98 (souris, gavage, 28 jours) |
Les tests de toxicité pour une même cyanotoxine sont difficiles à mettre en perspective car ils ne sont pas tous effectués dans les mêmes conditions (méthodes de mise en contact, organismes testés, extraits purs vs extraits algales). Dans le dernier cas, il pourrait y avoir des effets de synergie et/ou d’antagonisme entre l’organisme étudié et tous les métabolites d’origine algale, contrairement à la seule présence de cyanotoxines. Il faut être prudent dans l’interprétation des résultats..
Développement
Les méthodes de confirmation présentent la possibilité d’établir des méthodes d’analyses multi-toxines, qui après optimisation des conditions analytiques, permettent de réduire à un minimum les analyses et ainsi les établir comme méthodes de routine.
L’étude de phénomène comme la bioaccumulation, et son impact sur la consommation d’organismes infectés, nécessite un protocole d’extraction des cyanotoxines intégrées à l’intérieur de matrices complexes. Un protocole connu sous le nom de « dispersion de la matrice sur phase solide » utilise les propriétés d’adsorption que possèdent des substances comme la silice, l’alumine et le sable. Ainsi, la matrice est mélangée avec l’adsorbant dans un mortier et l’échantillon résultant est déposé dans une petite colonne chromatographique et les analytes sont élués sélectivement.
Les méthodes de préparation d’échantillons sont fastidieuses et plus particulièrement l’extraction sur phase solide, qui peut s’étendre sur une journée. Pour optimiser le temps réponse des analytes, une modification de l’appareillage chromatographique peut être accomplie de façon à effectuer la purification et la pré-concentration automatiquement. Pour ce faire, il faut relier une colonne de charge à la colonne analytique par un système de valve. Ensuite, l’échantillon liquide est élué sur la colonne de charge, à l’aide de pompes indépendantes du système chromatographique, et les analytes y sont sélectivement adsorbés, alors que l’éluant et les contaminants sont rejetés au rebut. Ensuite, on effectue une permutation des valves de façon à ce que la colonne de charge soit en aval de la colonne analytique et on utilise les pompes du système chromatographique pour éluer nos analytes à l’intérieur de la colonne analytique. Ceci permet de diminuer drastiquement le temps total d’analyse, soit moins d’une heure par échantillon. Cette procédure a été utilisée avec succès pour la quantification d’agents anti-infectieux dans les eaux usées et il est envisageable qu’elle puisse très bien fonctionner pour les cyanotoxines.
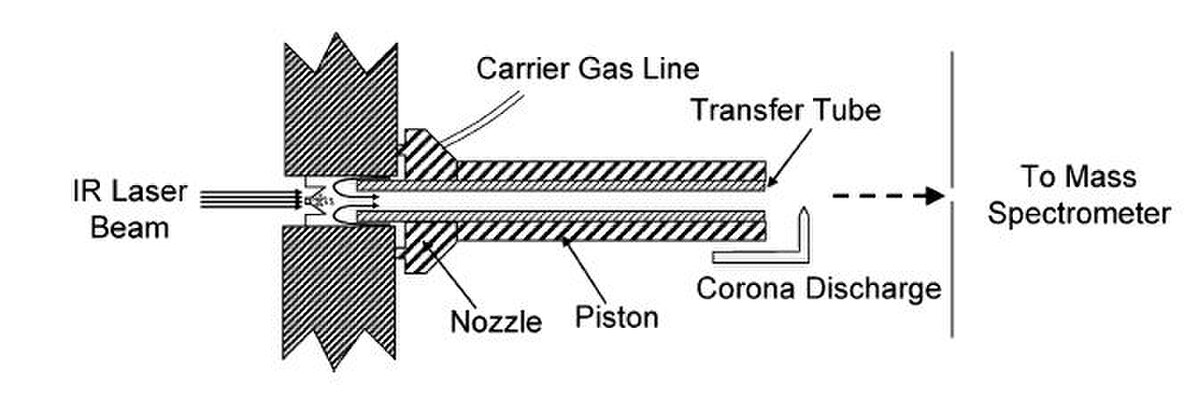
Une nouvelle méthode d’ionisation des analytes pourraient drastiquement diminuer le temps d’analyse, soit la désorption thermique induite par diode laser couplée à l’ionisation chimique à pression atmosphérique.
L’échantillon est dissous dans un solvant qui est par la suite déposé dans une plaque analytique à 96 puits. Le solvant est séché et l’échantillon solide passe en phase vapeur sous l’effet d’un bombardement laser. Ensuite, les analytes gazeux neutres sont ionisés chimiquement à pression atmosphérique. Ceci produit des ions moléculaires en moins de trois secondes qui sont par la suite analysés par spectrométrie de masse, pour un temps total inférieur à dix secondes. Les avantages de cette méthode, outre le temps excessivement bas d’analyse, est la possibilité de programmer des rampes d’élévation de température, ainsi que le temps de maintien de cette température, de façon à faire passer sélectivement les analytes en phase gazeuse. Ceci fait en sorte qu’il n’est plus nécessaire d’effectuer de séparation chromatographique avant l’analyse par spectrométrie de masse. De plus, aucune matrice et solvant ne sont utilisés, réduisant la présence de bruit de fond. Cette technologie a été utilisée avec succès dans le cadre de l’étude de l’inhibition du cytochrome P450. Il serait donc envisageable d’analyser les cyanotoxines par cette méthode à condition que les analytes se volatilisent avant de se dégrader sous l’effet de la chaleur.