Dichlorure de soufre - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Dichlorure de soufre | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | liquide rouge | ||
| Propriétés chimiques | |||
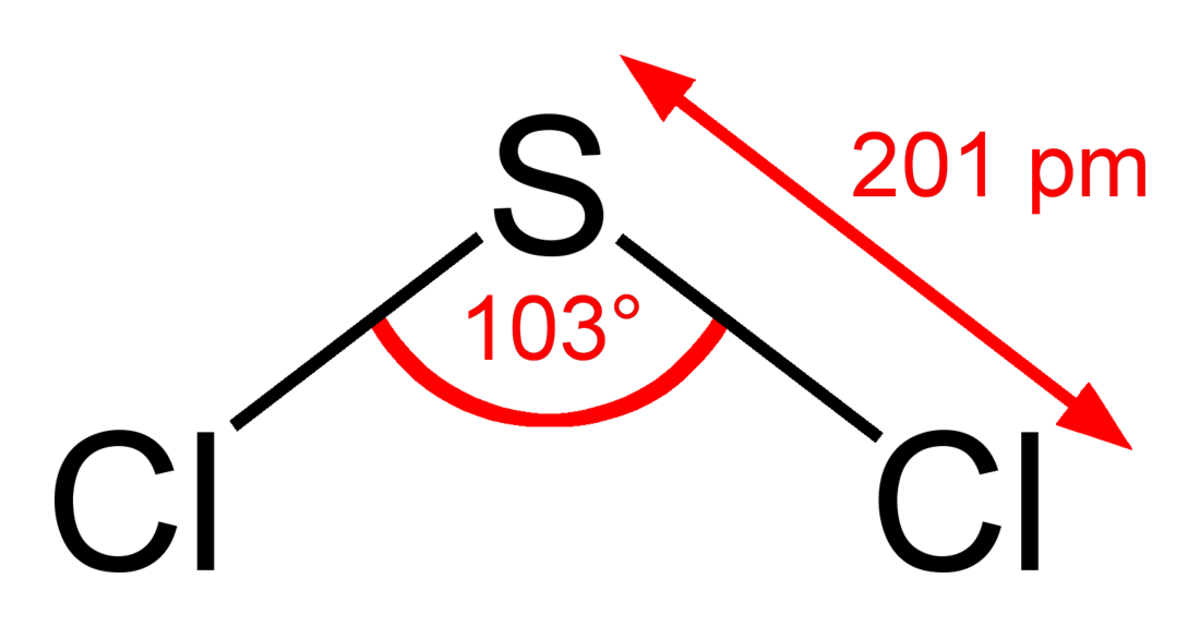
| Formule brute | SCl2 | ||
| Masse molaire | 102,971 ± 0,009 g·mol-1 | ||
| Moment dipolaire | 0,36 ± 0,01 D | ||
| Propriétés physiques | |||
| T° ébullition | 59 °C | ||
| Masse volumique | 1,621 g·cm-3 à 15 °C | ||
| T° d’auto-inflammation | 230 °C | ||
| Point d’éclair | 118 °C | ||
| Pression de vapeur saturante | 10,1 mbar à -23 °C 217,5 mbar à 20 °C | ||
| Thermochimie | |||
| S0 | |||
| S0 | 183,68 J·K-1·mol-1 | ||
| ΔH0 | -17,57 kJ·mol-1 | ||
| ΔH0 | -49,79 kJ·mol-1 | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 14, 34, 37, 50, | |||
| Phrases S : 1/2, 26, 45, 61, | |||
| | |||
| |||
| | |||
|
2 0 2 | |||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 0,001 ppm | ||
| | |||
Le dichlorure de soufre est un composé soufré de formule brute SCl2. C'est un composé utilisé pour la chloration de composés organiques notamment sur les doubles liaisons. Il peut former le gaz moutarde par réaction avec l'éthylène.
Utilisation
Ce composé chloré est principalement utilisé dans la synthèse d'additifs pour huile de lubrification. Une petite quantité sert à la production d'antioxydants, de composés organo-sulfurés et de composés en caoutchouc.
Production et synthèse
La production de dichlorure de soufre s'effectue par réaction entre du chlore gazeux avec du chlorure de soufre à basse température. La purification s'effectue par distillation en présence de composés stabilisateurs.
Propriétés physico-chimiques
Le dichlorure de soufre est instable à température et dimérise pour former du chlorure de soufre
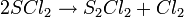
Cette réaction peut être empêchée par l'ajout de pentachlorure de phosphore ou de trichlorure de thiophosphoryle.




















































