Diméthylformamide - Définition
La liste des auteurs de cet article est disponible ici.
Structure et propriétés
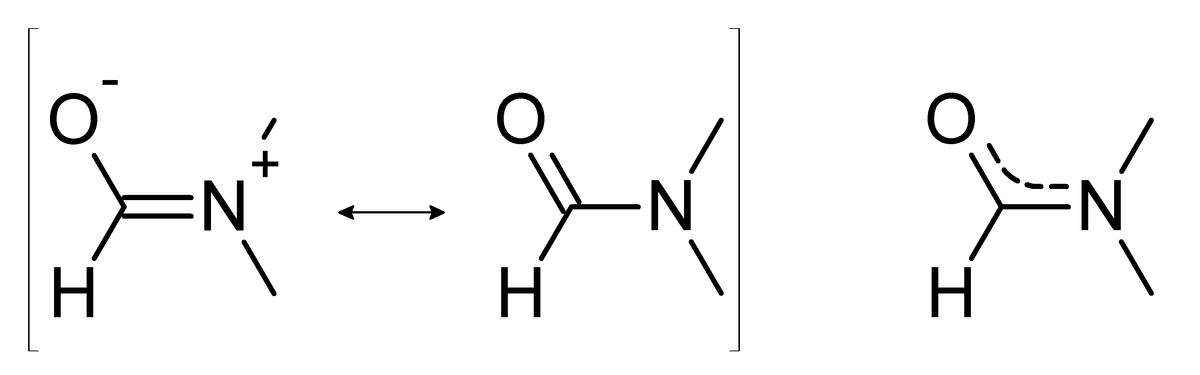
Du fait de la contribution de 2 formes de résonance possibles l'indice de liaison de la liaison carbonyle C=O est diminuée, tandis que celui de la liaison carbone-azote est augmenté. Ainsi, le spectre IR du DMF laisse apparaître une bande plus basse (de fréquence 1 675 cm-1) que celle d'un groupement carbonyle (C=O) non substitué. Aussi, à cause du caractère partiellement double de la liaison C-N, la rotation autour de son axe est gênée, et lente. Les deux méthyles ne sont donc pas équivalents en spectroscopie RMN (faisant apparaître 2 singulets de 3 protons, au lieu d'un seul singulet de 6 protons).
Production
Il est produit par la réaction de la diméthylamine et du monoxyde de carbone à basses pression et température en conditions catalytiques.
Applications
On utilise tout d'abord le DMF en tant que solvant, en raison de son haut point d'ébullition. Il est aussi utilisé dans la production de fibres acryliques et de plastiques. On l'utilise également afin de coupler des peptides dans l'industrie pharmaceutique, dans la production de pesticides, colles, cuirs synthétiques, fibres, films, et revêtements.
Le DMF est un réactif pour la synthèse des aldéhydes de Bouveault, ainsi que dans la réaction de Vilsmeier-Haack, une des méthodes les plus employées dans la formation d'aldéhydes aromatiques. Le DMF pénètre beaucoup de matières plastiques et les fait gonfler. Il est donc fréquemment utilisé comme composant des dissolvants de peintures.
Toxicité
Le DMF a été corrélé au cancer chez l'humain, et on le suppose à l'origine de défauts de naissance. Dans certains secteurs de l'industrie, les femmes sont écartées de l'utilisation du DMF. Pour beaucoup de réactions, il peut être remplacé par le DMSO (Diméthylsulfoxyde), le DMAC (Diméthylacétamide) ou la NMP (N-méthyl-2-pyrrolidone). Attention cependant : le NMP a récemment été classé reprotoxique par l'European Chemical Bureau . D'après l'IARC (International agency for research on cancer), le DMF pourrait être une substance cancérigène, bien que l'agence de protection de l'environnement ne le considère pas comme un risque de cancer.
Précautions
La réaction entre l'hydrure de sodium et le DMF est quelque peu dangereux ; dès 26 °C, on observe une décomposition exothermique. En laboratoire, tout dégagement de chaleur est (en principe) rapidement compensée et mis sous contrôle par un bain de glace et ceci reste une combinaison de réactifs courante. On a recensé plusieurs accidents.
Codes de classement
- ICSC : 0457 04
- PGCH : 0226