Glace - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
La glace est de l'eau à l'état solide.
À la pression atmosphérique normale (101 325 Pa), l'eau est sous forme de glace lorsque sa température est inférieure à sa température de fusion qui est, par convention, de 0 °C (soit 273,15 K).
Cependant, en l'absence de cristal de glace, de l'eau calme peut être refroidie à des températures inférieures à 0 °C sans se congeler, dans un état d'équilibre instable appelé surfusion, et atteindre ainsi des températures allant jusqu'à -20 °C.
La température de fusion de la glace servit de point fixe pour la définition originelle de l'échelle de températures Celsius.
Physique de la glace
La glace présente plus de onze variétés allotropiques dont les domaines d'existence sont représentés dans le diagramme de phase ci-après. Elle existe également sous forme amorphe.
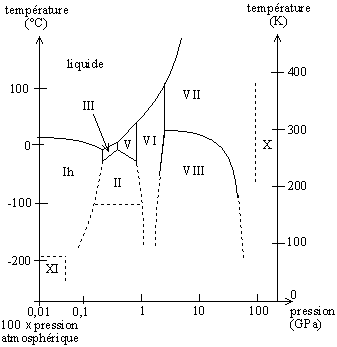
À la pression atmosphérique normale (et jusqu'à une pression d'environ 0,2 GPa ou 2 000 bars), les molécules d'eau de la glace ordinaire forment une structure cristalline suivant un réseau hexagonal (a = 4,52 Å, c = 7,37 Å), dont la stabilité est assurée par des liaisons hydrogène ; cette variété allotropique est appelée « glace 1h » ou « glace Ih » (h pour hexagonal). Cette structure présente une faible compacité, et la densité de la glace ordinaire est inférieure à celle de l'eau (917 kg/m³ pour de la glace pure à 0 °C, pression atmosphérique normale).
Ceci explique que la température du point de fusion de la glace ordinaire s'abaisse avec l'augmentation de la pression (il s'agit d'une anomalie : les températures de fusion croissent normalement avec la pression) jusqu'à un minimum de -22 °C (cf diagramme de phase de la glace) pour une pression d'environ 0,2 GPa (ici commence le domaine de la glace III).
En fonction des conditions de température et de pression, la glace peut adopter d'autres structures cristallines, généralement plus compactes que la glace ordinaire ; certaines de ces variétés de glace peuvent se rencontrer dans les conditions extrêmes régnant à la surface d'autres planètes ou satellites du système solaire :
- glace Ic (basse température, cubique à faces centrées, densité : env. 0,9) ;
- glace II (basse température, orthorhombique centrée, densité : env. 1,2) ;
- glace III (basse température, tétragonal, densité : env. 1,1) ;
- glace IV (basse température, densité : 1,29) ;
- glace V (haute pression, basse température, monoclinique à base centrée, densité : env. 1,2) ;
- glace VI (haute pression, basse température, tétragonale, densité : env. 1,3) ;
- glace VII (haute température, haute pression, cubique simple, densité : env. 1,7) ;
- glace VIII (haute pression, tétragonale centré, densité : env. 1,6) ;
- glace IX (haute pression, tétragonale, densité : env. 1,2) ;
- glace X (haute pression, cubique centré) ;
- glace XI ;
- glace XII (haute pression, basse température, tétragonale, densité : env. 1,3) ;
- glace XIII (obtenue à -143,15 °C et 0,5 GPa) ;
- glace XIV (obtenue à -155,15 °C et 1,2 GPa).
Propriétés physiques de la glace ordinaire (Ih)
La masse volumique de la glace est de 917 kg/m³ à 0 °C, et son coefficient de dilatation linéaire est d'environ 9·10− 5/K, toujours à 0 °C.
Propriétés mécaniques
Le coefficient de dilatation linéaire de la glace est d'environ 9·10− 5/K à 0 °C. La compressibilité de la glace est de l'ordre de 12·10− 12/Pa.
La limite d'élasticité de la glace varie énormément suivant la qualité de la glace utilisée : 10 kPa pour la glace de glacier, 60 kPa pour de la glace artificielle.
Les valeurs admises pour le module d'Young de la glace se situent environ à 9,33 GPa (V.F. Petrenko, Physics of Ice)
Sa limite de plasticité est de 3,5 MPa (en compression) ; le rapport limite de plasticité/limite d'élasticité de la glace se range parmi les plus grands de tous les solides connus (environ 2 pour l'acier, et jusqu'à 10 pour le fer doux).
Une formule empirique permet de déterminer la pression supportable par une couche de glace ; si l'on considère H l'épaisseur de glace en centimètres, alors 4·H² donnera le nombre de kg par m² que la couche pourra supporter sans se briser.
Propriétés thermiques
À 0 °C, la chaleur latente de fusion de la glace est de 333 kJ·kg− 1 et sa capacité thermique massique est de 2,06 kJ·kg− 1·K− 1 ; celle-ci n'est que la moitié de la capacité thermique massique de l'eau à 0 °C (4,217 kJ·kg− 1·K− 1), et varie de façon quasi linéaire en fonction de la température (+ 0,17 %/K).
La conductivité thermique de la glace est de 2,1 W·m− 1·K− 1 à 0 °C, et augmente avec l'abaissement de la température (pente de l'ordre de − 0,57 %/K) ; elle est donc toujours bien supérieure à la conductivité thermique de l'eau à 0 °C, égale à 0,55 W·m− 1·K− 1.






















































