Estérification - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
L'esterification est une réaction en chimie organique permettant de synthétiser un ester. Basiquement, il s'agit de la condensation d'un alcool sur un acide carboxylique, auquel cas la réaction est réversible (rétro-estérification) et renversable (saponification), mais elle peut s'effectuer à partir d'autres réactifs, en particulier à la place de l'acide carboxylique un de ses dérivés, chlorure d'acyle ou anhydride d'acide, changeant le type de réaction et son rendement.
Généralités
Les esters sont habituellement synthétisés par la réaction d'un acide carboxylique avec un alcool avec élimination d'une molécule d'eau. Toutefois il existe un certain nombre d'autres voies de synthèses impliquant des anhydrides, des chlorures d'acyle, des amides, des nitriles, des éthers, des aldéhydes, des cétones ou d'autres esters.
Estérification de dérivés d'acides carboxyliques
La synthèse des esters à partir d'acides carboxyliques présente de nombreux inconvénients : un rendement maximal de l'ordre de 2/3 dans les cas les plus favorables (alcools primaires) et plus que médiocre dans les cas les plus défavorables (5 % pour les alcools tertiaires), une cinétique lente, même catalysée (si la réaction est arrêtée trop rapidement, le rendement baisse encore plus).
Une solution consiste donc à utiliser plutôt des dérivés d'acides, comme les chlorures d'acyles ou les anhydrides d'acides.
Réactions
- A partir des chlorures d'acyles :
- A partir des anhydrides d'acide :
Propriétés
- Avantages :
- Ces réactions sont totales.
- Elles sont en général relativement rapides, mais nécessitent assez régulièrement une catalyse. Les catalyseurs ne servent qu'à activer et rendre encore plus réactif le dérivé d'acide. Typiquement, dans le cas de l'utilisation d'un chlorure d'acyle, les catalyseurs utilisés sont la pyridine ou la triéthylamine (qui jouent alors le rôle de piège à HCl).
- Inconvénients :
- Les chlorures d'acyle et les anhydrides d'acides réagissent facilement avec l'eau (ils s'hydrolisent très facilement). Cela oblige à prendre des précautions de manipulation (éviter tout contact avec les muqueuses).
- Bien qu'à la base, les réactions soient totales, le rendement n'est pas de 100 %. En effet, une fois la réaction faite, il faut extraire l'ester du milieu, et les étapes pour y arriver sont généralement des équilibres physico-chimiques.
On a de plus besoin de piéger le HCl formé :
- en utilisant par exemple une base telle la pyridine ou la triéthylamine.
- un piège constitué d'un flacon contenant de la soude.
- Les réactions à partir d'anhydrides sont moins vives et moins rapides (les anhydrides sont moins réactifs).
En industrie, on utilise donc plutôt la voie des acides carboxyliques, plus facile dans la mise en œuvre. Cependant, dans le cas de l'industrie pharmaceutique ou cosmétique, les chlorures d'acyle ou les anhydrides peuvent être utilisés car les produits sont à haute valeur ajoutée.
Mécanismes
- À partir des chlorures d'acyle
-
- 1re étape : addition nucléophile de l'alcool sur le chlorure d'acyle.

-
- 2e étape : départ de HCl
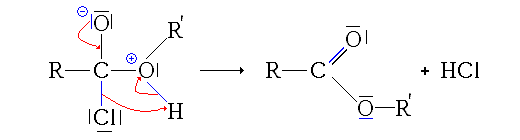
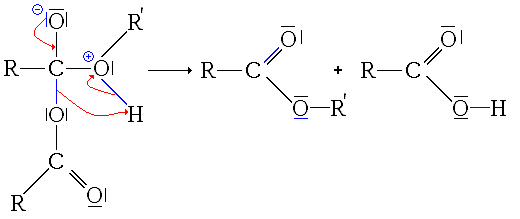
- À partir des anhydrides d'acide
-
- 1re étape : addition nucléophile de l'alcool sur l'anhydride.

-
- 2e étape : départ de RCOOH