Extracellular signal-regulated kinases - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Les protéines ERK1/2 sont des enzymes, des kinases, qui ajoutent des groupements phosphate à d'autres protéines afin de les activer. ERK1/2 font partie de la famille des MAP kinases qui sont des protéines jouant un rôle dans la division, la croissance et la prolifération cellulaires.
Généralités
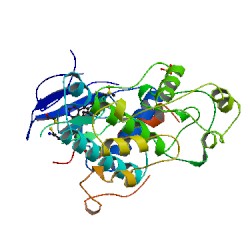
Les protéines ERK-1 et ERK-2 signifiant Extracellular signal-regulated kinases sont des protéines codées par les gènes 16p11.2 pour ERK-1 et 22p11.2 pour ERK-2. Ce sont deux isoformes respectivement de poids moléculaires de 43 kDa (379 acides aminés) et 41 kDa (360 acides aminés) chez l’humain. Quand ces protéines deviennent phosphorylées, elles acquièrent un poids moléculaire de 44 kDa et 42 kDa respectivement pour ERK-1 et pour ERK-2. Bien que ERK-1 et ERK-2 possèdent plusieurs autres noms (voir tableau 1), les chercheurs les nomment couramment ERK1/2. Ces deux enzymes ont un degré d’homologie de 83%, car on remarque une similitude dans la séquence et la composition de leurs acides aminés. ERK1/2 sont des kinases qui sont activées par l’ajout obligatoire de deux groupements phosphate à une thréonine (T) et à une tyrosine (Y) : T202 et Y204 pour ERK-1 et T184 et Y186 pour ERK-2. Ces protéines kinases ajoutent elles aussi un ou des groupement(s) phosphate à des endroits spécifiques, particulièrement sur des résidus tyrosine, thréonine ou sérine pour activer à leur tour d’autres protéines. ERK1/2 font partie de la famille des MAP kinases, mitogen-activated protein kinases (voir tableau 2).
Pendant les années 90, la compréhension sur le fonctionnement de la cascade de signalisation des MAP kinases impliquant ERK1/2 était déjà bien établie et relativement bien comprise et les recherches sur ces deux protéines sont encore d’actualité, puisque ces protéines ont un rôle important dans la plupart des organismes vivants.
TABLEAU 1: Dénominations des protéines ERK-1 et ERK-2
| ERK-1 | ERK-2 |
|---|---|
| Mitogen-activated protein kinase 3 | Mitogen-activated protein kinase 1 |
| Extracellular signal-regulated kinase 1 (ERK-1) | Extracellular signal-regulated kinase 2 (ERK-2) |
| MAP kinase 1 (MAPK 1) | MAP kinase 2 (MAPK 2) |
| Microtubule-associated protein 2 kinase | Mitogen-activated protein kinase 2 |
| p44-ERK1 | p42-MAPK |
| ERT2 | ERT1 |
| MNK1 |
Voie de signalisation impliquant ERK1/2
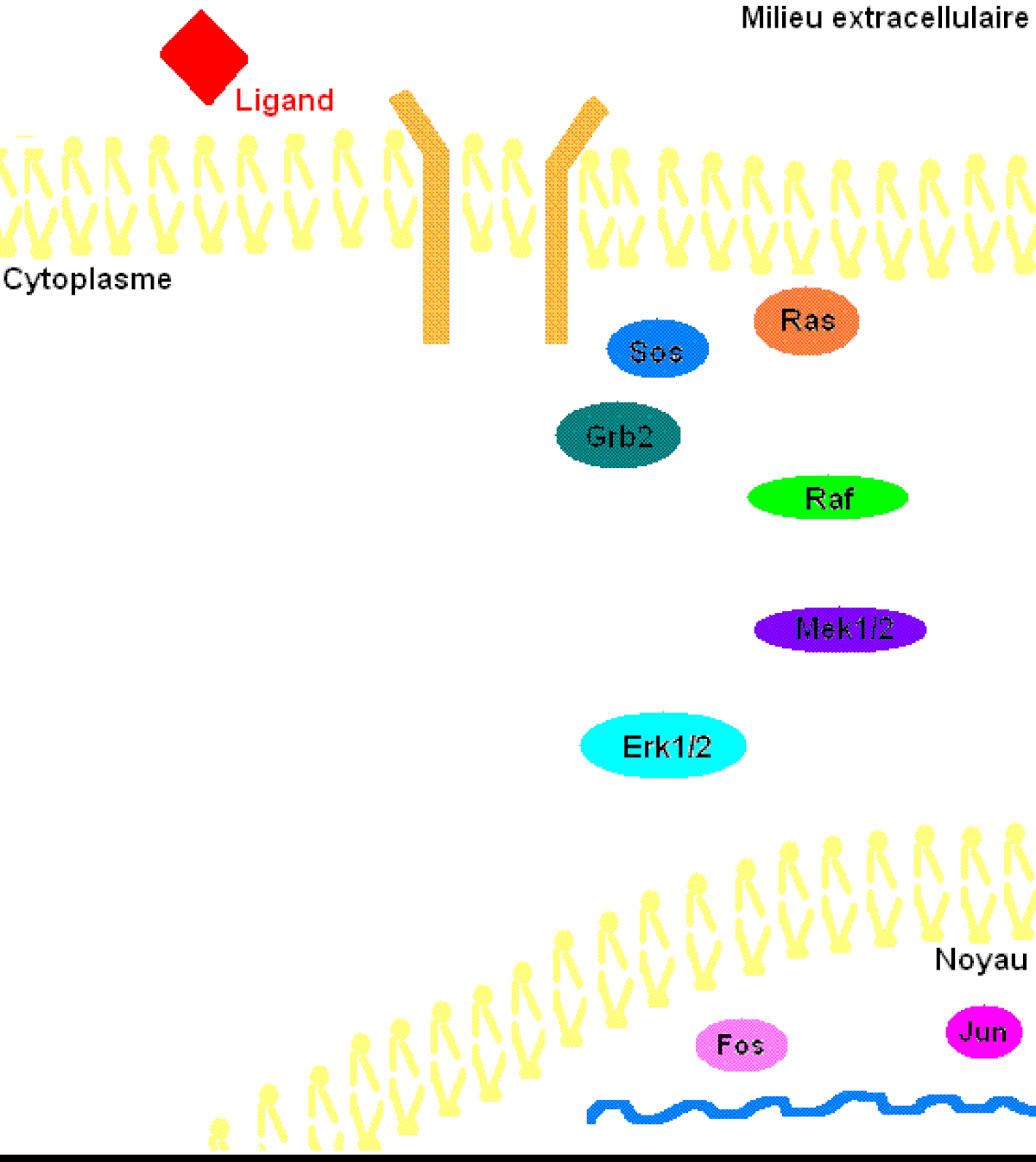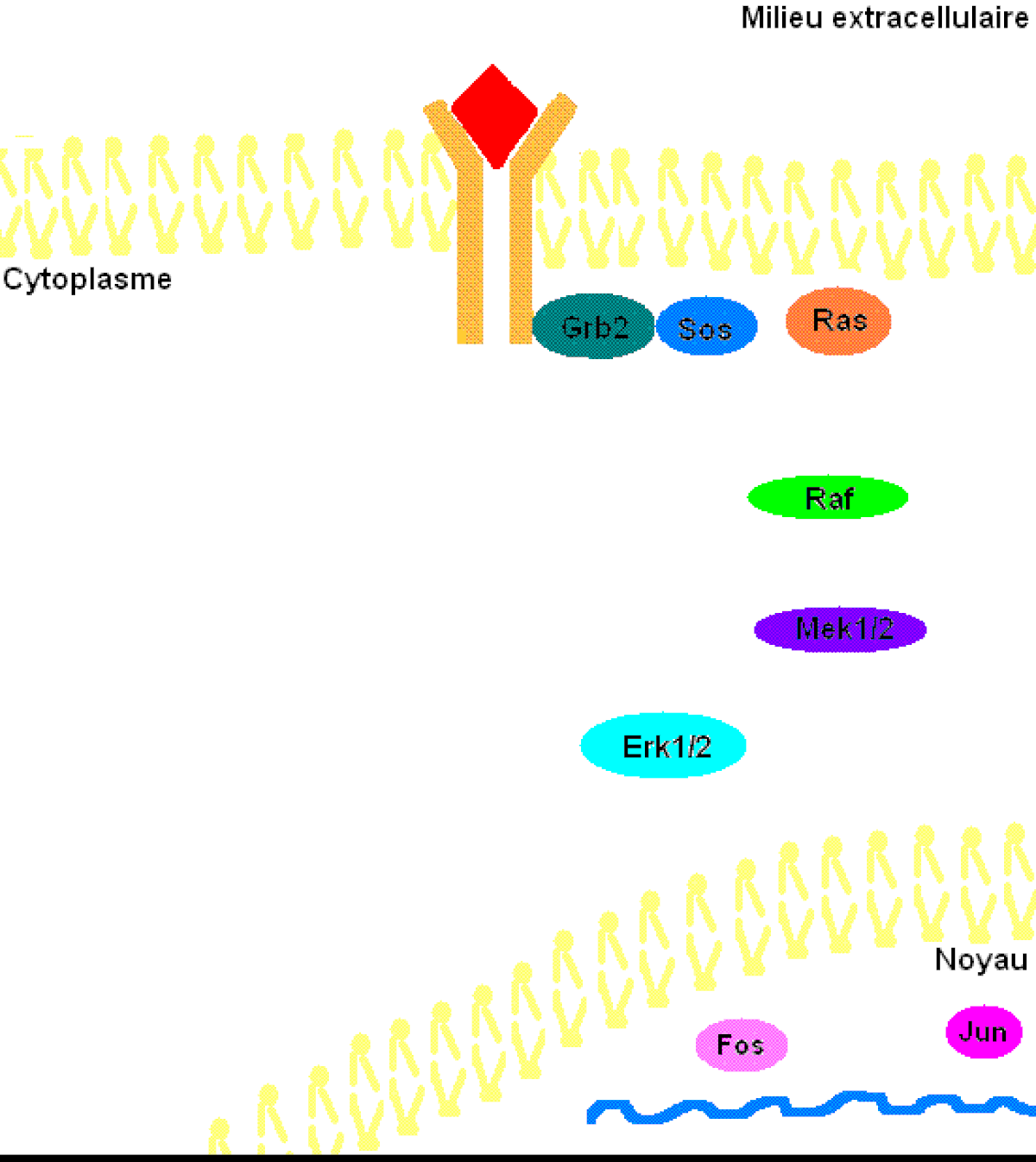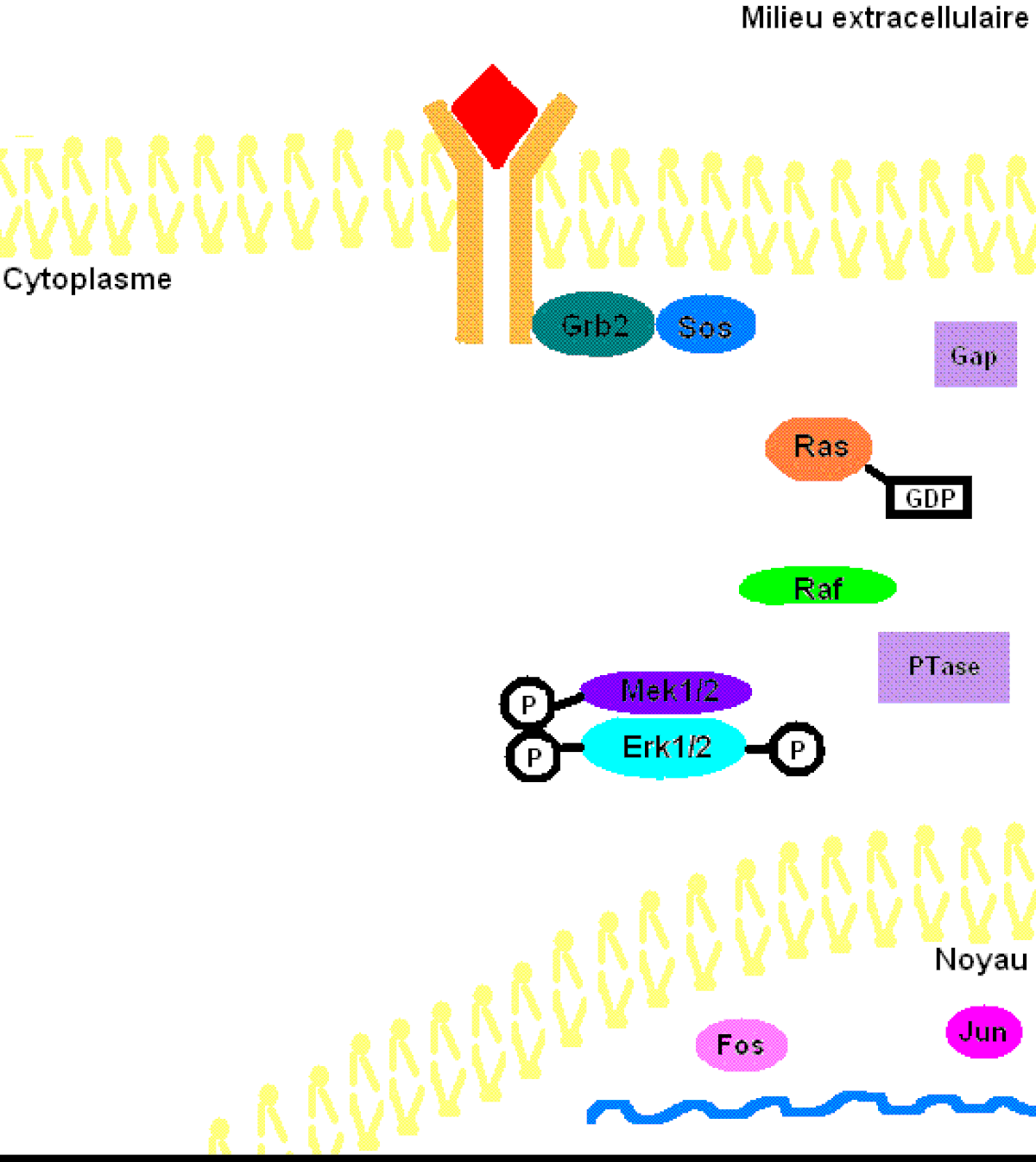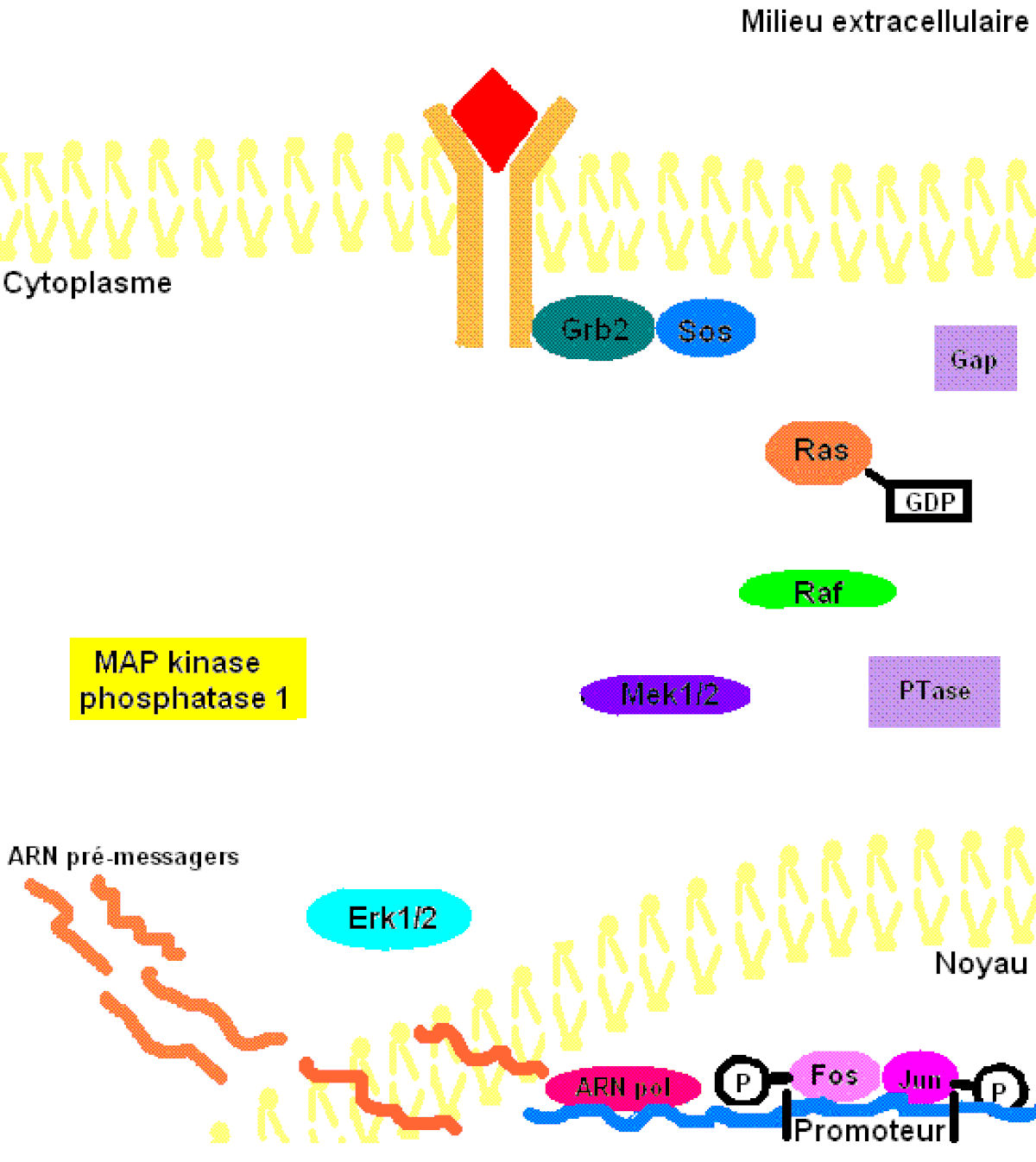
Pour mieux comprendre les effets de ERK1/2 dans l’organisme, il faut connaître à prime abord les détails de la voie de signalisation Ras-dépendante ERK1/2 MAP kinase. En premier lieu, un ligand vient se lier à un récepteur tyrosine kinase. Cette liaison provoque la dimérisation des deux monomères de ce type de récepteur, notamment les récepteurs EGF (epidermal growth factor) et PDGF (Platelet-derived growth factor), entraînant alors une autophosphorylation du récepteur (besoin d’ATP pour cela). Ensuite, la protéine adaptatrice Grb2, qui posséde des domaines SH2 et SH3, s’accroche au récepteur tyrosine kinase par son domaine SH2 au résidu phosphotyrosine du récepteur, tandis que les deux domaines SH3 se fixent aux résidus de proline de la protéine adaptatrice Sos. Puis, Grb2-Sos entre en contact avec Ras qui se situe dans le cytosol, près de la membrane plasmique. Ras, cette petite protéine G d’une seule sous-unité, devient sous sa forme active, chargée de GTP. Elle entre en interaction avec la protéine sérine/thréonine kinase Raf qui phosphoryle à son tour les MAP kinase kinases, MEK1/2. Cette cascade de phosphorylation se poursuit par l’activation des protéines d’intérêt ERK1/2 sur leurs résidus tyrosine et thréonine. Ainsi, ERK1/ 2 entrent ensuite dans le noyau cellulaire et ajoutent des groupements phosphate aux résidus sérine et thréonine du facteur de transcription Fos; le facteur de transcription Jun étant préalablement phosphorylé par la protéine kinase JNK (une autre protéine de la famille des MAP kinases). Ces deux facteurs de transcription forment alors un hétérodimère nommé complexe transcriptionnel AP-1 (activating protein-1) qui agit sur le gène c-Fos, un gène de réponse précoce (nécessaire pour passer de l’état G0 à G1 du cycle cellulaire). De plus, les facteurs de transcription de la famille ETS-domain, entre autres, Elk-1, SAP-1 et NET/ERP/SAP-2/ELK-3 sont des cibles de ERK1/2. De plus, à ce jour, 173 gènes anti-prolifératifs ont été identifiés comme étant des cibles de ERK1/2 qui les régulent négativement pendant la phase de division cellulaire G1. Entre autres, Tob qui fait partie de cette famille de gène antiprolifératif, empêchant la transcription des cyclines D1, est inactivé lorsqu’il est phosphorylé par ERK1/2. ERK1/2 ont également un effet direct sur les cyclines D, particulièrement les cyclines D1, dont le promoteur de celles-ci possède un site fonctionnel de liaison AP-1. On sait que les cyclines sont importantes pour le passage de la cellule de la phase G1 à la phase S. Ceci assurant donc le commencement de la division cellulaire. Tout récemment, les chercheurs ont découvert que ERK1/2 ont la capacité de phosphoryler, entre autres, la protéine kinase RSK. Cette dernière phosphoryle l’histone 3 sur la sérine 10. Les histones ont la possibilité de remodeler la chromatine et rendre certaines sections du génome accessibles afin d’utiliser des gènes spécifiques pour la division cellulaire.
Il faut préciser que, dans une cellule normale, chaque protéine de la cascade est inactivée après un certain temps pour éviter leur activation constitutive. Or, la protéine kinase Ras sera désactivée par une protéine Gap (GTPase activator) qui sont des régulateurs dans cette voie de signalisation afin d’accélérer l’hydrolyse du GTP en GDP. Pour ce qui est des protéines kinases, elles seront désactivées par les phosphatases (PTases) dont leur rôle est d’enlever les groupements phosphate. Précisément, la MAP kinase phosphatase-1 déphosphoryle les résidus tyrosine et thréonine de ERK1/2 (Voir la figure 3 pour une vue d'ensemble de la voie de signalisation Ras-dépendante ERK1/2 MAP kinase).


















































