Hydrazine - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
Introduction
| Hydrazine | |||||||
|---|---|---|---|---|---|---|---|
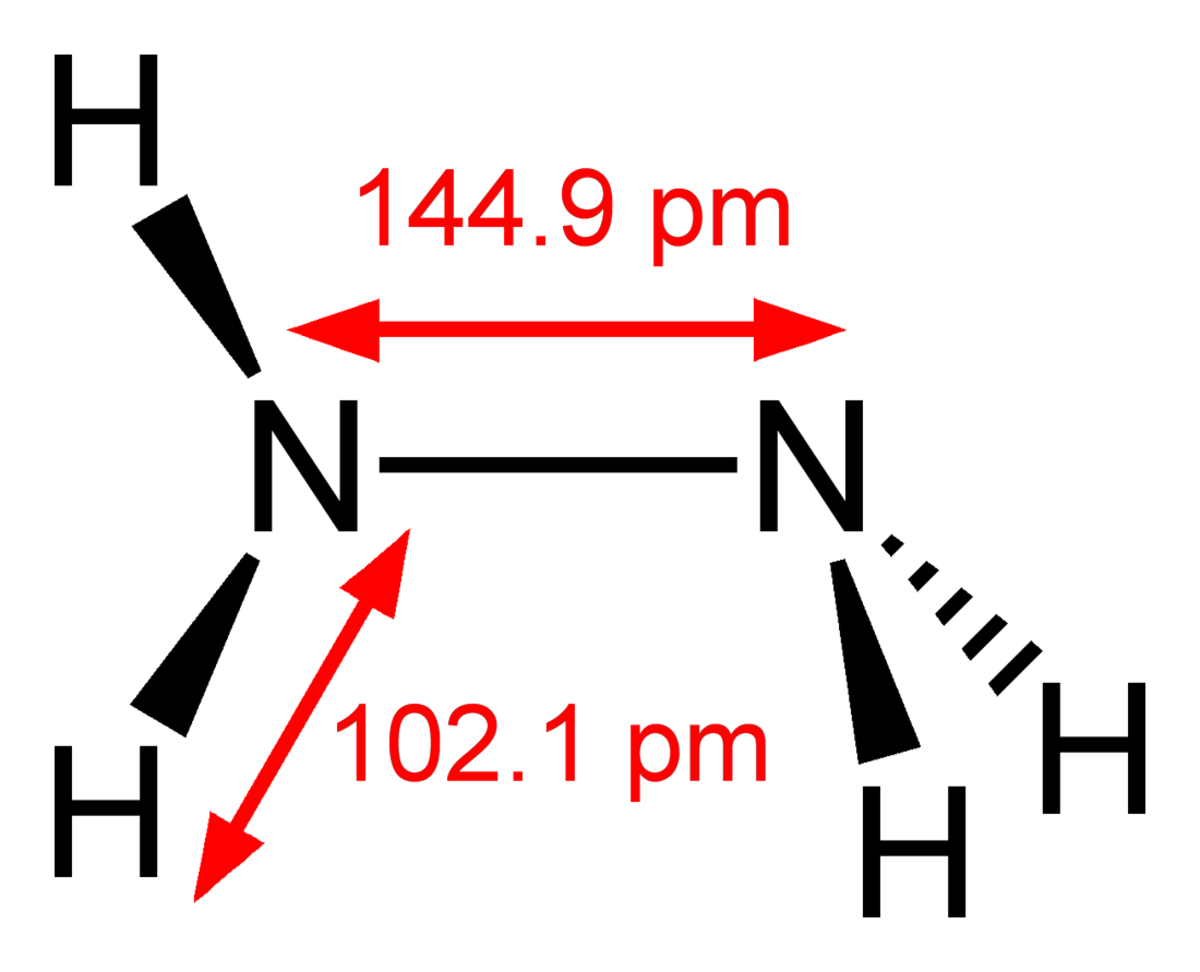
| |||||||
| Général | |||||||
| Nom IUPAC | |||||||
| Synonymes | diamine | ||||||
| No CAS | |||||||
| No EINECS | |||||||
| PubChem | |||||||
| SMILES | |||||||
| InChI | |||||||
| Apparence | liquide hygroscopique, incolore, fumant, d'odeur âcre. | ||||||
| Propriétés chimiques | |||||||
| Formule brute | N2H4 | ||||||
| Masse molaire | 32,0452 ± 0,0007 g·mol-1 | ||||||
| Moment dipolaire | 1,75 D | ||||||
| Diamètre moléculaire | 0,390 nm | ||||||
| Propriétés physiques | |||||||
| T° fusion | 2 °C | ||||||
| T° ébullition | 114 °C | ||||||
| Solubilité | miscible à l'eau et aux solvants organiques polaires | ||||||
| Masse volumique | 1,01 g·cm-3 | ||||||
| Point d’éclair | 38 °C (c.f.) | ||||||
| Limites d’explosivité dans l’air | 1,8–100 %vol | ||||||
| Pression de vapeur saturante | anhydre : 21 mbar (20 °C), solution à 64 %m : | ||||||
| Viscosité dynamique | 0,9 mPa·s à 25 °C | ||||||
| Point critique | 147,0 bar, 379,85 °C | ||||||
| Thermochimie | |||||||
| S0 | 238,68 J·K-1·mol-1 | ||||||
| S0 | 121,52 J·K-1·mol-1 | ||||||
| ΔH0 | 95,35 kJ·mol-1 | ||||||
| ΔH0 | 50,63 kJ·mol-1 | ||||||
| ΔH° | 41,8 kJ·mol-1 (1 atm, 113,55 °C); 44,7 kJ·mol-1 (1 atm, 25 °C) | ||||||
| Cp | |||||||
| PCI | -622,08 kJ·mol-1 (gaz) | ||||||
| Propriétés électroniques | |||||||
| 1re énergie d'ionisation | 8,1 ± 0,15 eV (gaz) | ||||||
| Propriétés optiques | |||||||
| Indice de réfraction |
| ||||||
| Précautions | |||||||
| | |||||||
| |||||||
| Phrases R : 10, 23/24/25, 34, 43, 45, 50/53, | |||||||
| Phrases S : 45, 53, 60, 61, | |||||||
| | |||||||
| |||||||
| | |||||||
|
3 3 3 | |||||||
| Autre | Peut attaquer le système nerveux. Mortel à hautes doses. | ||||||
| | |||||||



| |||||||
| | |||||||




Danger | |||||||
| | |||||||
| Groupe 2B : Peut-être cancérogène pour l'homme | |||||||
| Écotoxicologie | |||||||
| LogP | -3,1 | ||||||
| Seuil de l’odorat | bas : 3 ppm haut : 4 ppm | ||||||
| | |||||||
L’hydrazine (ou Diazène), de formule chimique N2H4 et de formule semi-développée NH2-NH2, est un composé chimique liquide d’apparence semblable à l'eau, avec une odeur rappelant celle de l’ammoniaque. Elle est miscible à l'eau en toutes proportions et est largement utilisée en chimie organique et comme composant de certains carburants pour fusées.





















































