Indène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Indène | |||
|---|---|---|---|
| |||
| Général | |||
| Synonymes | Benzocylopentadiène Indonaphtène | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| Propriétés chimiques | |||
| Formule brute | C9H8 | ||
| Masse molaire | 116,1598 ± 0,0078 g·mol-1 | ||
| Susceptibilité magnétique | χM 80,5×10-6 cm3·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | -1,7 °C | ||
| T° ébullition | 182,6 °C | ||
| Solubilité | quasi-insoluble dans l'eau | ||
| Masse volumique | 0,996 g·cm-3 à 20 °C | ||
| Point d’éclair | 58,00 °C (coupelle fermée) | ||
| Pression de vapeur saturante | 2 mbar à 20 °C 2,9 mbar à 30 °C 9 mbar à 50 °C | ||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| Phrases R : 10, 65, | |||
| | |||
| |||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 0,0042 ppm | ||
| | |||
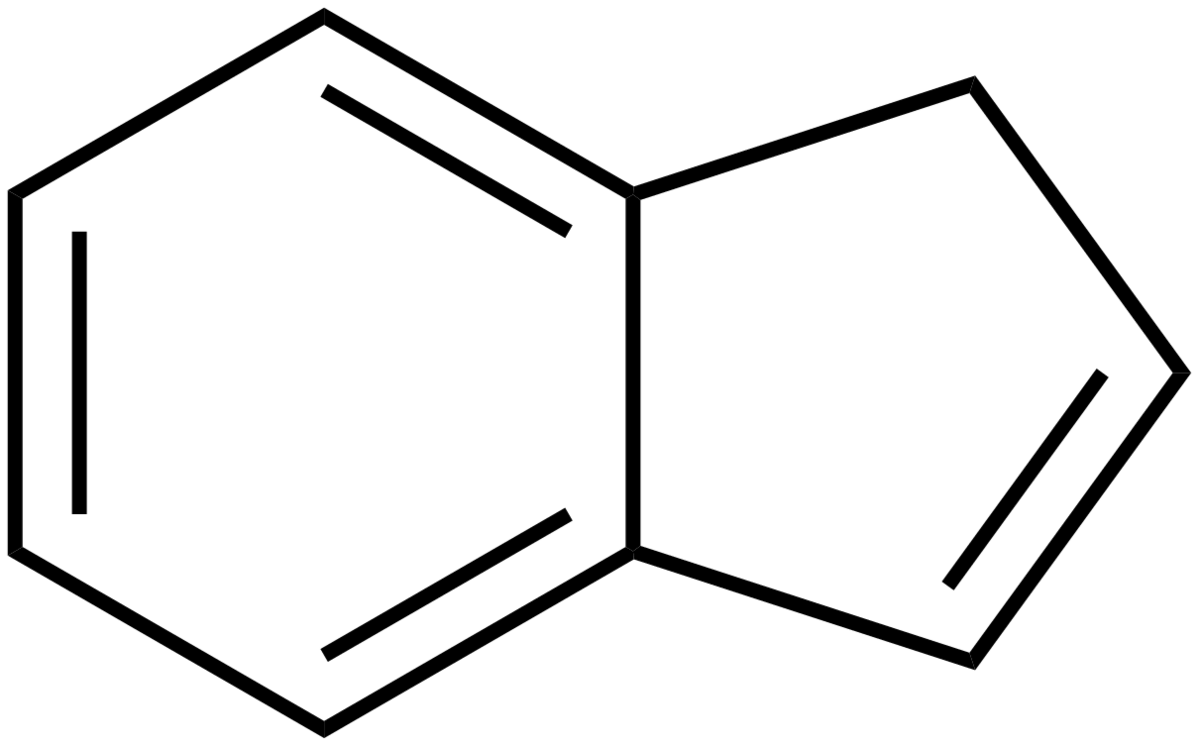
L'indène est un hydrocarbure bicyclique de formule C9H8. Il se présente sous la forme d'un liquide incolore à jaune pâle. Il est composé d'un cycle benzénique fusionné avec une cycle de cyclopentadiène.
Son nom provient de la contraction de indonaphthène.
Synthèse/extraction
L'indène est naturellement présent dans les fraction du goudron bouillant entre 175 °C et 185 °C. Il peut être obtenu en chauffant cette fraction avec du sodium, qui précipite sous forme de « sodio-indène ». Cette réaction utilise les propriétés d'acide faible de l'indène, par sa déprotonation par le sodium. Le sodio-indène est ensuite reconvertit en indène par distillation à la vapeur.
Utilisations
L'indène est utilisé comme solvant pour des réactions organiques. Il est utilisé pour la synthèse de résines indène-coumarone. Il sert de ligand pour les métaux de transition en catalyse homogène. C'est aussi un réactif pour la synthèse de l'azulène.
Réactivité
L'indène, en particulier le 2H-indène se dimérise rapidement à l'air libre ou à la lumière. L'oxydation de l'indène par le dichromate acide donne l'acide homophthalique. Il se condense avec l'oxalate d'éthyle en présence d'éthoxyde de sodium pour former un ester indene-oxalique. Il se condense également avec des composés carbonylés (cétones, aldéhydes) en milieu alcalin pour former des benzofulvènes (composés extrêmement colorés). L'indène peut aussi être transformé en anion indène qui est utilisé chimie organométallique, où il est considéré comme un bon ligand, dû à l'effet indényle.