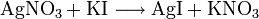Iodure d'argent - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Iodure d'argent | |
|---|---|
| |
| Général | |
| No CAS | |
| No EINECS | |
| Apparence | poudre jaune cristaux hexagonaux ou cubiques noircit à la lumière |
| Propriétés chimiques | |
| Formule brute | AgI |
| Masse molaire | 234,7727 ± 0,0002 g·mol-1 |
| Moment dipolaire | 4,55 ± 0,05 D |
| Propriétés physiques | |
| T° fusion | 558 °C |
| T° ébullition | 1 506 °C |
| Solubilité | 3,10-5g/L eau insol dans les acides sol dans HI concentré chaud sol ds cyanures ou iodures alcalins 35 mg·l-1 ammoniaque à 10 % |
| Masse volumique | 5,67 |
| Thermochimie | |
| ΔH° | 143,9 kJ·mol-1 (1 atm, 1 506 °C) |
| Précautions | |
| | |
| Phrases S : 22, 24/25, | |
| | |
L'iodure d'argent (ou AgI) est un composé inorganique hautement insoluble dans l'eau, photosensible (utilisé pour cette raison en photographie).
Préparation
AgI est obtenu par précipitation dans une solution de nitrate d'argent avec l'iodure de potassium :
Cette réaction est utilisée en chimie analytique pour mettre en évidence les anions I–, car l'AgI qui en résulte produit un précipité jaunâtre difficilement soluble. Au contraire de l'iodure d'argent, les chlorure d'argent (AgCl) et bromure d'argent (AgBr), eux-mêmes peu solubles, se laissent dissoudre en présence de thiosulfate de sodium (avec formation de complexes). Les anions Cl–, Br– et I– peuvent être ainsi différenciés à l'aide des solutions de thiosulfate de sodium et d'ammoniaque.
Propriétés chimiques
L'iodure d'argent est photosensible : il se décompose lentement en argent et iode. À la lumière du soleil, sa couleur devient vert-gris.
AgI se dissout en présence de ligands forts comme les cyanures ou les thiocyanates.
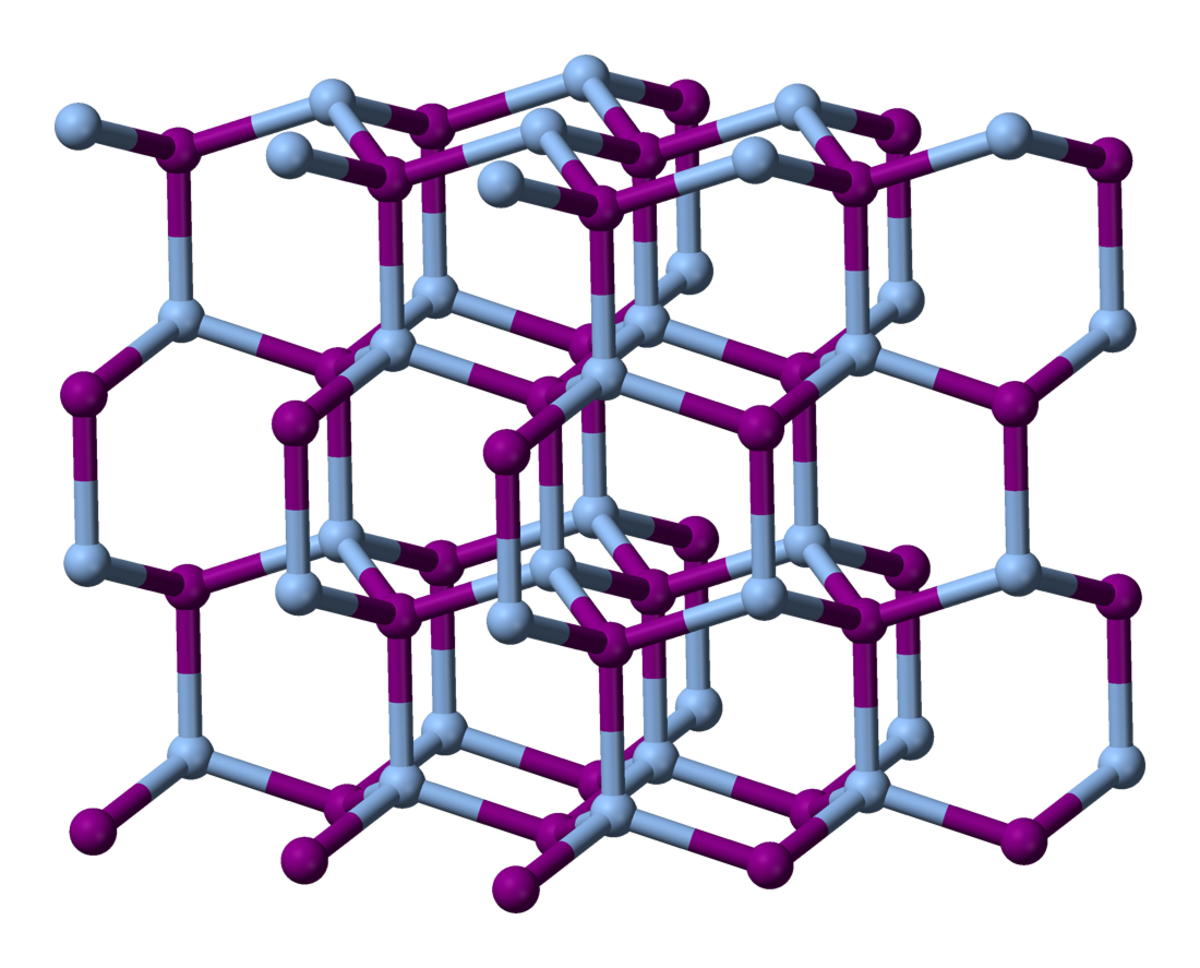
Structure cristalline
Elle change avec la température, avec trois phases connues :
- jusqu'à 147 °C (420 K), l'AgI existe dans une phase β, qui a une structure hexagonale de type wurtzite. Il est alors connu comme iodargyrite en tant que minéral ;
- au dessus de 147 °C, l'Agl va passer en phase α : structure cubique centrée avec des ions d'argent qui semblent distribués au hasard (ils sont délocalisés) ;
- une phase cubique métastable γ existe également en dessous de 147 °C, avec une structure de type blende de zinc.
Usages
- L'iodure d'argent est utilisé comme antiseptique local.
- Dans le domaine de la photographie, des pains de soude de goémoniers ont été utilisés pour produire l'iodure d'argent nécessaire à l'artisanat et au début de l'industrie de la photographie après que Daguerre ait découvert la sensibilité de l'iodure d'argent à la lumière.
- L'iodure d'argent est utilisé dans des roquettes pour produire artificiellement de la pluie et éviter la grêle. Grâce à une structure cristalline proche de celle de la glace, l'iodure joue le rôle d'agent de nucléation des gouttelettes d'eau qui transformeront la vapeur d'eau en pluie. Ce phénomène est décrit comme ensemencement des nuages.
En dépit de la toxicité de ce produit, ce sont 50 000 kg/an d'iodure d'argent qui sont ainsi dispersés dans l'air à cette fin, consommant pour chaque ensemencement un total de 10 à 50 grammes de cristaux.
| Cessna 210 équipé d'un dispositif de dissémination dans l'air d'iodure d'argent pour l'ensemencement de nuages à fin de faire pleuvoir. |