Phénolphtaléine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Phénolphtaléine | ||
|---|---|---|

| ||
| Général | ||
| Nom IUPAC | ||
| No CAS | (acide) (basique) (Na) | |
| No EINECS | (Na) | |
| SMILES | ||
| InChI | ||
| Apparence | cristaux blancs
| |
| Propriétés chimiques | ||
| Formule brute | C20H14O4 C20H12O42-,Na+ | |
| Masse molaire | 318,3228 ± 0,0182 g·mol-1 362,28 g.mol-1 | |
| pKa | pKa1 : <0 pKa2 : 9,4 | |
| Propriétés physiques | ||
| T° fusion | 258 à 263 °C | |
| Solubilité | eau : 1,4 g.mol-1 éthanol : 80 g.mol-1 | |
| Masse volumique | 1,299 | |
| Cristallographie | ||
| Classe cristalline ou groupe d’espace | Pna21 | |
| Paramètres de maille | a = 19,270 Å b = 14,819 Å | |
| Volume | 3 253,12 Å3 | |
| Densité théorique | 1,300 | |
| Précautions | ||
| | ||
| ||
| Phrases R : 22 - 40 | ||
| Phrases S : 36/37 - 45 24/25 | ||
| | ||
| Groupe 2B : Peut-être cancérogène pour l'homme | ||
| | ||
La phénolphtaléine ou 3,3-bis(4-hydroxyphényl)-1-(3H)-monobenzofuranone (le symbole φφ (phi-phi) est utilisé) est un composé organique de formule chimique CHO. C'est un indicateur de pH, c'est-à-dire un composé qui change de couleur selon la valeur du pH de la solution dans laquelle on le place.
Histoire
La phénolphtaléine fut découverte et synthétisée en 1871 par Adolf von Baeyer, par condensation de l'anhydride phtalique sur deux équivalents de phénol. Elle tire son nom des deux réactifs.
Réaction en présence de base
En solution, la phénolphtaléine peut se présenter sous plusieurs formes en fonction de la quantité relative de base présente dans le milieu.
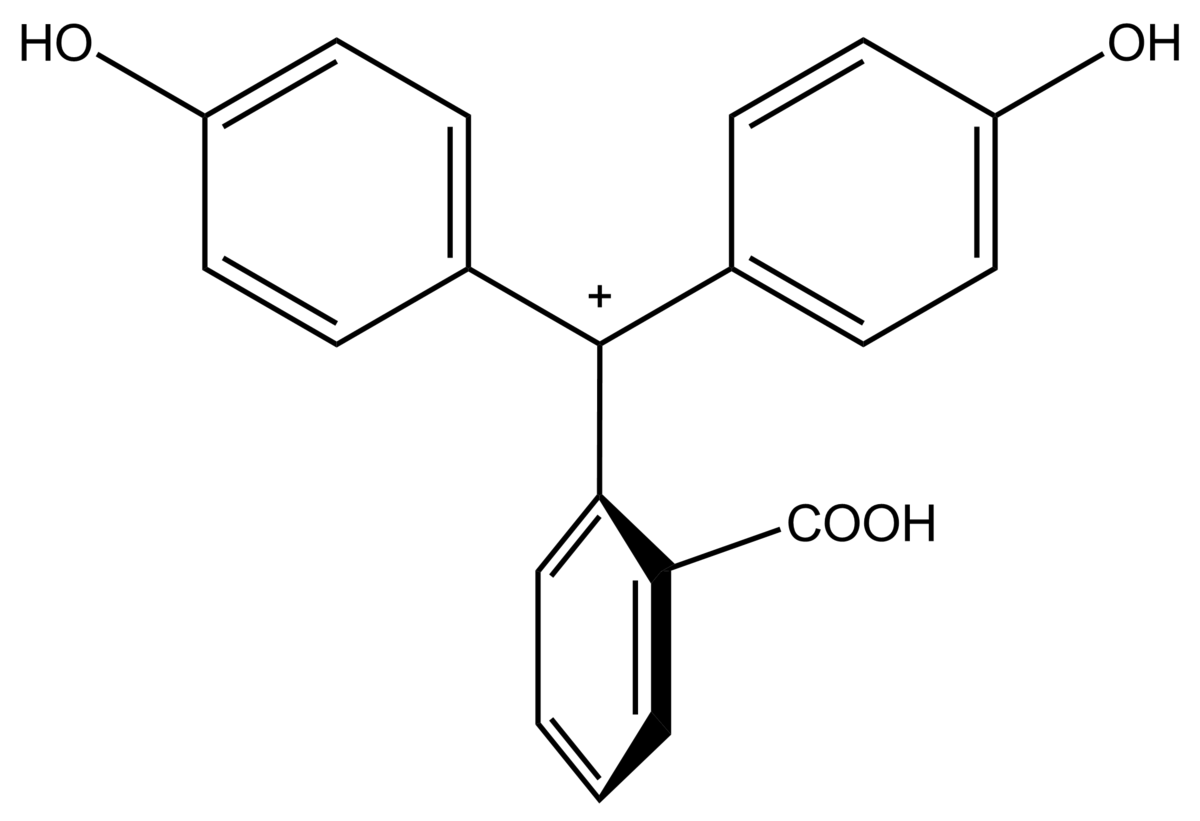
- I. Pour des solutions acides : la phénolphtaléine est sous sa forme dite acide. La molécule possède un cycle de type lactone (1).
- II. Lors d'un ajout de base, le cycle lactone s'ouvre et évolue vers une structure triphénylcarbinol (2).
- III. Si on continue à ajouter de la base, on amène la perte d'une molécule d'eau dans la structure et on forme une espèce ionique résonante de couleur rouge pourpre (3)(la longueur d'onde majoritairement absorbée se trouvant vers 550nm).
- IV. Pour un excès de base, la coloration pourpre disparait et le milieu redevient incolore traduisant la formation en solution du composé (4).
Structure chimique de la phénolphtaléine
Le changement de couleur de la phénolphtaléine est due à la modification de la structure chimique de la molécule lors du passage de la forme protonée (milieu acide) à celle de sa forme déprotonée (milieu basique). Dans le cas de la phénolphtaléine, la forme acide présente une structure aromatique (présence de 3 cycles benzéniques) alors que la forme basique est de type quinoïdique.
La forme basique de la phénolphtaléine est généralement associée à deux ions Na+. Il s'agit donc d'un sel de disodium.
| Espèce | In+ | H2In | In2− | In(OH)3− |
|---|---|---|---|---|
| Structure |
|

|

|

|
| Structure 3D |

|

|

|

|
| pH | < 0 | 0−8,2 | 8,2−12,0 | > 12,0 |
| Conditions | Très acide | acide à peu basique | basique | très basique |
| Couleur | orange | incolore | rose à fuchsia | incolore |
| Image |

|

|



















































