Anhydride phtalique - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
Introduction
| Anhydride phtalique | ||
|---|---|---|
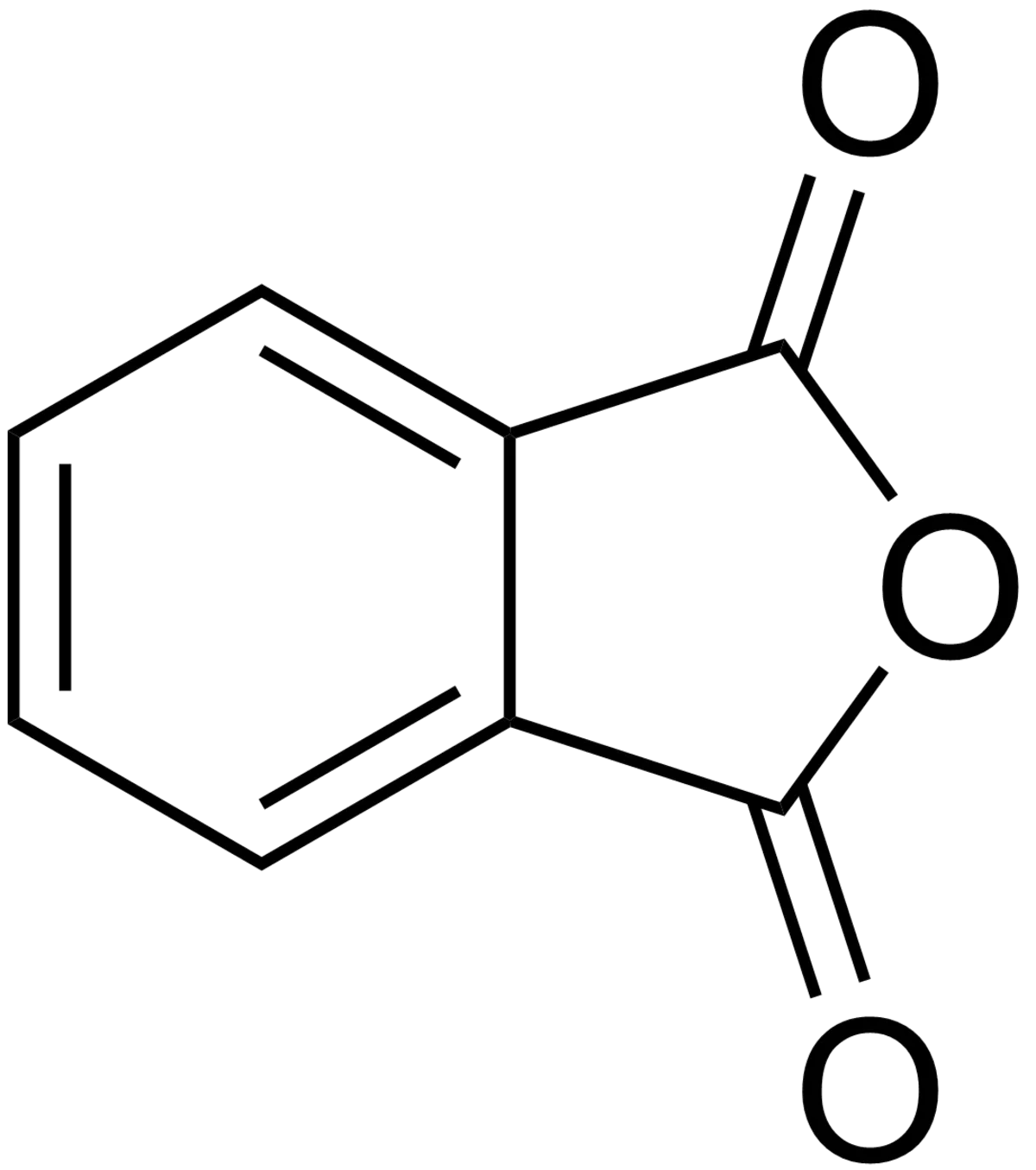
| ||
| Général | ||
| Nom IUPAC | ||
| Synonymes | 1,3-isobenzofuranedione | |
| No CAS | ||
| No EINECS | ||
| SMILES | ||
| InChI | ||
| Apparence | cristaux blancs, brillants, d'odeur caractéristique. | |
| Propriétés chimiques | ||
| Formule brute | C8H4O3 | |
| Masse molaire | 148,1156 ± 0,0076 g·mol-1 | |
| Propriétés physiques | ||
| T° fusion | 131 °C | |
| T° ébullition | 284 °C (sublime) | |
| Solubilité | 0,62 g/100g ,eau (réagit lentement avec l'eau) | |
| Masse volumique | 1,53 g·cm-3 | |
| T° d’auto-inflammation | 570 °C | |
| Point d’éclair | 152 °C (coupelle fermée) | |
| Limites d’explosivité dans l’air | 1,7–10,4 %vol | |
| Thermochimie | ||
| Cp | ||
| Précautions | ||
| | ||
| ||
| Phrases R : 22, 37/38, 41, 42/43, | ||
| Phrases S : (2), 23, 24/25, 26, 37/39, 46, | ||
| | ||
|
1 3 0 | ||
| | ||

| ||
| | ||

Danger | ||
| Écotoxicologie | ||
| LogP | 1,6 | |
| Seuil de l’odorat | bas : 0,05 ppm | |
| | ||
L'anhydride phtalique est une molécule de formule C8H4O3. C'est l'anhydride de l'acide phtalique. C'est un composé de grande importance en chimie, notamment pour la fabrication de résines synthétiques, de plastiques, de colorants et de pigments.
Synthèse
Jusque dans les années 1960, l'anhydride phtalique était presqu'exclusivement produit par oxydation catalytique du naphtalène, extrait du goudron de houille (coal tar).
- C10H8 + 4.5 O2 → C6H4(CO)2O + 2 H2O + 2CO2
Il fut à partir des années 60, et de façon croissante (85% de la production dans les années 80, la quasi totalité de nos jours) synthétisé à partir de l'ortho-xylène, produit par reformage ou par craquage du pétrole.
- C6H4(CH3)2 + 3 O2 → C6H4(CO)2O + 3 H2O
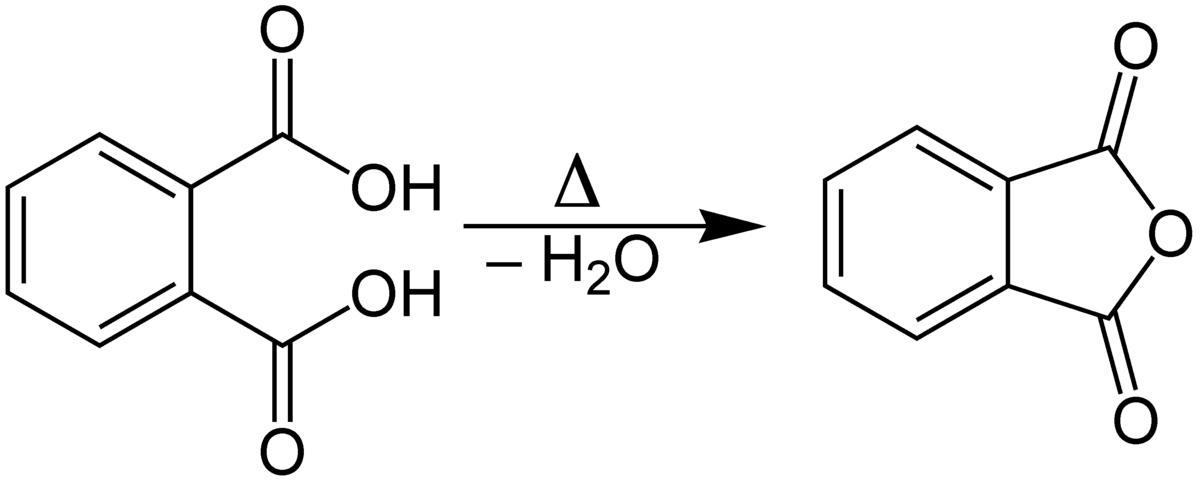
En laboratoire, l'anhydride phtalique est obtenu par chauffage et déshydratation de l'acide phtalique :