Potentiel hydrogène - Définition
La liste des auteurs de cet article est disponible ici.
Acides et bases
Bronsted et Lowry ont donné une définition simple des concepts d’acide et de base comme étant respectivement un donneur et un accepteur de proton. D’autres conceptions de l’acidité sont utilisées dans les milieux non protiques (milieux où l’espèce échangeable n’est pas le proton), telle la théorie de Lewis :
| Théorie | Acide | Base | Domaine d’application |
| Arrhenius | donneur de H+ | donneur de OH- | eau |
| Bronsted | donneur de H+ | accepteur de H+ | solvant protique |
| Lewis | accepteur de paire e- | donneur de paire e- | cas général |
Exemples :
- OH- est une base d’Arrhenius, Bronsted et Lewis ;
- NH3 est une base de Bronsted et Lewis, mais pas d’Arrhenius ;
- BF3 est un acide de Lewis, mais ni d’Arrhenius, ni de Bronsted.
Définitions
Définition classique
Depuis le milieu du XXe siècle, l’IUPAC reconnaît officiellement la définition de Sørensen du pH. Elle est utilisée dans les programmes scolaires (études supérieures) et les dictionnaires :
où a (on utilise aussi la notation a(H+) ou encore [H+]) est l’activité des ions hydrogène H+, sans dimension. Le pH est lui-même une grandeur sans dimension.
Cette définition formelle ne permet pas des mesures directes de pH, ni même des calculs. Le fait que le pH dépende de l’activité des ions hydrogènes induit que le pH dépend de plusieurs autres facteurs, tels que l’influence du solvant. Toutefois, il est possible d’obtenir des par le calcul à l’aide de définitions plus ou moins exactes de l’activité.
Loi de Nernst
L’IUPAC donne aujourd’hui une définition du pH à partir d’une méthode électrochimique expérimentale. Elle consiste à utiliser la relation de Nernst dans la cellule électrochimique suivante :
- Électrode de référence | Solution de KCl concentré | Solution X | H | Pt (électrode à hydrogène)
À l’aide de mesures de la fem (force électro-motrice) de la cellule avec une solution X et une solution S de référence, on obtient :
avec
- pH(X) : pH de la solution inconnue
- pH(S) : pH tabulé de la solution de référence S
- E(X) : fem de la cellule avec la solution inconnue X
- E(S) : fem de la cellule avec la solution de référence S à la place de la solution X
- F = 96 485 C⋅mol-1 : Constante de Faraday
- R = 8,314472 J⋅mol-1⋅K-1 : Constante universelle des gaz parfaits
- T : température absolue, en kelvin
L’électrode de travail est en fait une électrode à hydrogène (voir ). On considère le couple H+/H.
Le potentiel électrochimique de l’électrode de travail est donné par la relation de Nernst :
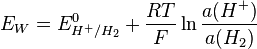
Sachant que le potentiel standard du couple H+/H est nul par convention (référence), on obtient :
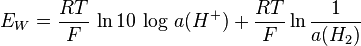
et donc
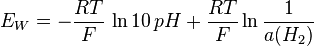
La fem de la cellule électrochimique est :
E = EW − Eref
Distinguons maintenant deux fem, E pour une solution inconnue, et E pour une solution connue S. En les soustrayant, on a :
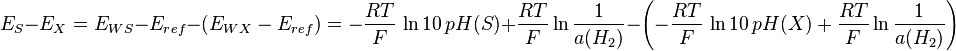
d’où
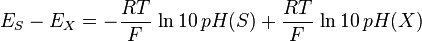
et enfin
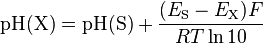
Cette définition du pH a été standardisée par la norme ISO 31-8 en 1992.
En solution aqueuse
Définitions approximatives
Les manipulations liées au pH en chimie étant le plus souvent réalisées en milieu aqueux, on peut déterminer plusieurs définitions approchées du pH en solution aqueuse. En utilisant deux définitions différentes de l’activité chimique, on peut écrire les deux relations ci-dessous. Elles sont valables dans le domaine limité des solutions aqueuses de concentrations en ions inférieures à 0 1 mol⋅L-1 et n’étant ni trop acide, ni trop basique, c’est-à-dire pour des pH entre 2 et 12 environ.
avec
- γ est le coefficient d’activité des ions H+, sans dimension
- [H+] est la concentration molaire en ions H+, en mol.L-1
- C0 = 1 mol⋅L-1 est la concentration standard
et
avec
- γ est le coefficient d’activité des ions H+, sans dimension
- m est la molalité des ions H+, en mol.kg-1
- m = 1 mol⋅kg-1 est la molalité standard
Pour des concentrations encore plus faibles en ions en solution, on peut assimiler l’activité des ions H+ à leur concentration (le coefficient d’activité tend vers 1). On peut écrire :
Par abus d’écriture, l’écriture n’est pas homogène, La concentration standard C étant souvent omise pour simplifier la notation. Cette relation est la plus connue et est la plus utilisée dans l’enseignement secondaire.
Pour des acides forts en solution aqueuse à des concentrations supérieurs à 1 mol⋅kg-1, l'approximation précédente n'est plus valable : il faut se ramener à la définition pH = − log(a(H3O + )) où l'activité des ions oxonium a(H3O + ) tend vers 1 quand la concentration augmente, soit un pH qui tend vers 0 + .
De même pour des bases fortes en solution aqueuse à des concentrations supérieurs à 1 mol⋅kg-1, l'activité des ion hydroxydes HO- tend vers 1 ; or, par définition de Ke, produit ionique de l'eau valant 10 − 14 à 25 °C, on a
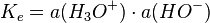
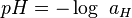
![pH=-\log_{10} \left( \gamma _H \frac{[H^+]}{C_0} \right)](https://static.techno-science.net/illustration/Definitions/autres/d/d60ea78b2f7fa4856f8c97fd35f83c17_d7eb9b54947f7393eaa0e7be139d57a7.png)
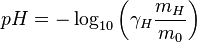
![pH=-\log_{10} \, [H^+]](https://static.techno-science.net/illustration/Definitions/autres/7/79c16ab4e4d46455a9727be2b811a933_236857cd62f68367761a2d822ca645e5.png)

















































