Potentiel hydrogène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Le pH en phase aqueuse au quotidien : | |
| Substance | pH approximatif |
|---|---|
| Acide chlorhydrique molaire | |
| Drainage minier acide (DMA) | |
| Acide d'un accumulateurs ou batterie | |
| Acide gastrique | |
| Jus de citron | |
| Cola | |
| Vinaigre | |
| Jus d’orange ou de pomme | |
| Bière | |
| Café | |
| Thé | |
| Pluie acide | |
| Lait | |
| Eau pure | |
| Salive humaine | |
| Sang | |
| Eau de mer | |
| Savon | |
| Ammoniaque | |
| Chaux | |
| Soude ou potasse molaire | |
Le potentiel hydrogène (ou pH) mesure l'activité chimique des ions hydrogènes (H+) (appelés aussi couramment protons) en solution. Notamment, en solution aqueuse, ces ions sont présents sous la forme de l'ion oxonium (également, et improprement, appelé ion hydronium). Plus couramment, le pH mesure l’acidité ou la basicité d’une solution. Ainsi, dans un milieu aqueux à 25 °C, une solution avec un pH :
- inférieur à 7 est acide ;
- supérieur à 7 est basique ;
- égal à 7 est neutre.
Historique
En 1893, le chimiste danois Søren Sørensen, qui travaille alors sur les effets des concentrations de quelques ions sur des protéines, remarque l’importance des ions hydrogènes et décide d’introduire le concept de pH. Dans l’article où est évoqué le pH pour la première fois, Sørensen utilise la notation p. Dans cette publication, il donne au sigle la signification en latin Pondus Hydrogenii (« poids de l’hydrogène ») ; mais dans les comptes-rendus de travaux qu’il rédige au sein du Carlsberg Laboratory de l’Université de Copenhague la même année, p est l’abréviation du mot allemand potenz (potentiel) et H est le symbole de l’hydrogène. Sørensen définit alors l’acidité d’une solution comme étant le cologarithme décimal de la concentration (exprimée en moles par litre) en ions hydrogène :
![p_H=-\log_{10} \left[ H^+ \right] \,](https://static.techno-science.net/illustration/Definitions/autres/1/1ce254da29892235ee1e0a8982ffc5d8_b25db5ed549fd432950e2507d0901817.png)
Le principe d’une telle échelle de pH est accepté par la communauté scientifique, notamment grâce au chimiste allemand Leonor Michaelis qui publie en 1909 un livre sur la concentration des ions hydrogène (H3CO4). En 1924, suite à l’introduction du concept d’activité, Sørensen publie un nouvel article précisant que le pH dépend plutôt de l’activité que de la concentration en H+ Entre temps, la notation pH a été adoptée, sans que l’on sache vraiment qui en a été l’initiateur :
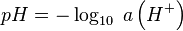
Par la suite, la lettre p est reprise dans plusieurs notations usuelles en chimie, pour désigner le cologarithme : pK, pOH, pCl… La signification du sigle pH a été adaptée par chaque langue. Ainsi, en français, on entendra par pH « potentiel hydrogène », on acceptera « potential hydrogen » en anglais, « potenz hydrogene » en allemand ou encore « potencial hidrógeno » en espagnol.
La notion d’acidité, qui était à la base uniquement qualitative, s’est vue dotée d’un caractère quantitatif avec les apports de la théorie de Bronsted-Lowry et du pH. Alors qu’au début du XXe siècle, on utilisait uniquement des indicateurs de pH pour justifier du caractère acide ou basique d’une solution, les évolutions en électrochimie ont permis à l’IUPAC de se tourner dans les années 1990 vers une nouvelle définition du pH, permettant des plus précises.

















































