Rofécoxib - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Rofécoxib | |
|---|---|
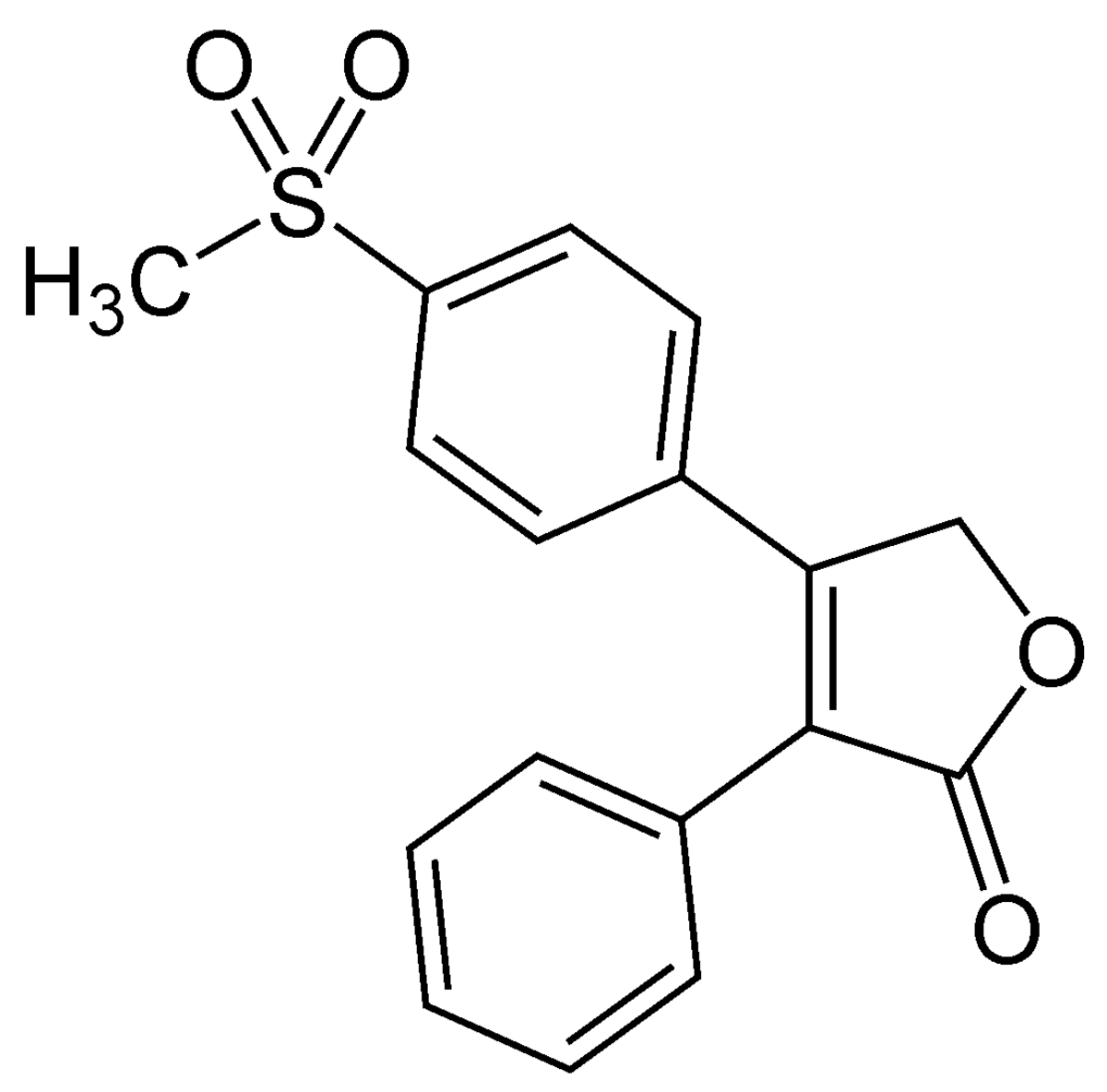
| |
| Général | |
| Nom IUPAC | |
| No CAS | |
| Code ATC | M01 |
| DrugBank | |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | Solide |
| Propriétés chimiques | |
| Formule brute | C17H14O4S |
| Masse molaire | 314,356 ± 0,021 g·mol-1 |
| Propriétés physiques | |
| Solubilité | Insoluble dans l'eau |
| | |
Le rofécoxib est un médicament anti-inflammatoire non stéroïdien (AINS) de la classe des coxibs qui était utilisé dans le traitement de l'ostéoarthrite, des états douloureux aigus, et de la dysménorrhée. Exemples de noms commerciaux : Vioxx®, Vioxx-Dolor®. Il a été retiré du marché en 2004 à cause de problèmes liés à un risque accru d'infarctus du myocarde (au niveau mondial le 30 septembre 2004).
Il a été introduit en 1999 par la multinationale Merck, et était disponible sur ordonnance en cachet et suspension buvable.
Rien qu'aux États-Unis, on estime que plus de 20 millions de personnes l'ont utilisé.
Inhibiteur COX-2 sélectif
Comme toute molécule de cette classe, elle possède une action anti-inflammatoire et sensiblement moins d'effets indésirables gastrique (brûlures, ulcère), mais plus de risque de développer des maladies cardio-vasculaires.
Contrairement à l'aspirine et aux anti inflammatoires non stéroïdiens classiques, elle ne modifie pas la sécrétion de Thromboxane A2 . De plus, elle diminue le taux de prostacycline circulante, cette dernière étant vaso-dilatatrice. l'aggrégabilité plaquettaire est alors augmentée.
Retrait du marché
Étude de la FDA
Une étude de l'administration américaine des denrées alimentaires et des médicaments (Food & Drug Administration FDA) concluait que 27 785 décès et problèmes cardiaques pourraient avoir été causés par le Vioxx entre 1999 et 2004. Ce n'est qu'après cette étude que Merck a alors décidé de retirer le Vioxx du marché, bien que de nombreuses études précédentes indiquaient des risques importants suite à l'utilisation de ce médicament.
Étude VIGOR
Le Rofecoxib, testé en double aveugle contre le naproxène sur 2000 patients sur neuf mois, un anti-inflammatoire classique, montre un doublement du nombre d'infarctus du myocarde. L'explication initiale était un effet "protecteur" du naproxene, qui n'a, en fait, jamais été démontré.
Étude APPROVe
Le Rofecoxib a été testé sur 2600 patients, contre un placebo, sur 3 ans. L'étude a été interrompue de manière précoce devant le quasi doublement du nombre d'infarctus du myocarde dans le groupe traité. Cette étude a été le prétexte à l'arrêt de la commercialisation de la molécule.
Retrait
Le retrait de la molécule a donné lieu à d'importantes controverses sur la diffusion des informations, et mettant en cause le laboratoire pharmaceutique. Il semble notamment que des données sur la majoration des risques cardiaques étaient disponibles dès 2001, soit trois ans avant le retrait de la molécule.
Il semble que le Rofecoxib comporte des effets secondaires graves, surtout en cas de prise prolongée ou de terrain prédisposant. Les autres COXIBS ne sont pas exempts des mêmes effets, même s'ils sont numériquement plus rares.
Volume financier
Depuis la mise sur le marché du Vioxx en 1999, Merck a engrangé un chiffre d'affaies annuel de 2 milliards de dollars. Le risque cardiovasculaire et de décès aurait pu être détecté près de quatre ans avant son retrait volontaire du marché mondial par son fabricant en 2004.

















































