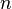Chlorure de sodium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Chlorure de sodium | |
|---|---|

| |
| Général | |
| Nom IUPAC | |
| No CAS | |
| No EINECS | |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | Poudre blanche ou cristaux cubiques transparents |
| Propriétés chimiques | |
| Formule brute | NaCl |
| Masse molaire | 58,443 ± 0,002 g·mol-1 |
| Moment dipolaire | 9,00117 D |
| Propriétés physiques | |
| T° fusion | 801 °C |
| T° ébullition | 1 465 °C |
| Solubilité | 357 g·l-1 (eau, 0 °C), 357 g·l-1 (eau, 25 °C), |
| Masse volumique | 2,17 g·cm-3 (25 °C), 1,549 g·cm-3 (fondu, 805 °C) |
| Viscosité dynamique | 1,93 mPa·s (solution aqueuse saturée) |
| Thermochimie | |
| S0 | 229,79 J/mol·K |
| S0 | 95,06 J/mol·K |
| S0 | 72,11 J/mol·K |
| ΔH0 | -181,42 kJ/mol |
| ΔH0 | -385,92 kJ/mol |
| ΔH0 | -411,12 kJ/mol |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 8,92 ± 0,06 eV (gaz) |
| Cristallographie | |
| Système cristallin | Cubique |
| Réseau de Bravais | cF |
| symbole de Pearson | cF8 |
| Classe cristalline ou groupe d’espace | Fm3m (n°225) |
| Notation Schönflies | O5h |
| Strukturbericht | B1 |
| Paramètres de maille | a = 5,6402 Å |
| Propriétés optiques | |
| Indice de réfraction |
|
| Précautions | |
| | |
| Produit non contrôlé | |
| Inhalation | Peut causer des irritations |
| Peau | Peut causer des irritations |
| Yeux | Peut causer des irritations |
| Écotoxicologie | |
| DL | rats par ingestion 3,75 ± 0,43 g·kg-1 |
| | |
Le chlorure de sodium est un composé chimique de formule NaCl. On l'appelle plus communément sel de table ou de cuisine, ou tout simplement sel dans le langage courant. C'est le principal produit dissout dans l'eau de mer ; on l'appelle alors sel marin.
On l'obtient :
- dans des marais salants par évaporation de l'eau de mer.
- dans des mines, par extraction du sel gemme (halite).
- en le synthétisant lors une réaction à hautes températures du dichlore (Cl2) et du sodium métallique.
Le chlorure de sodium est utilisé dans l'industrie chimique pour produire du chlore, de la soude caustique et de l’hydrogène.
Structure chimique
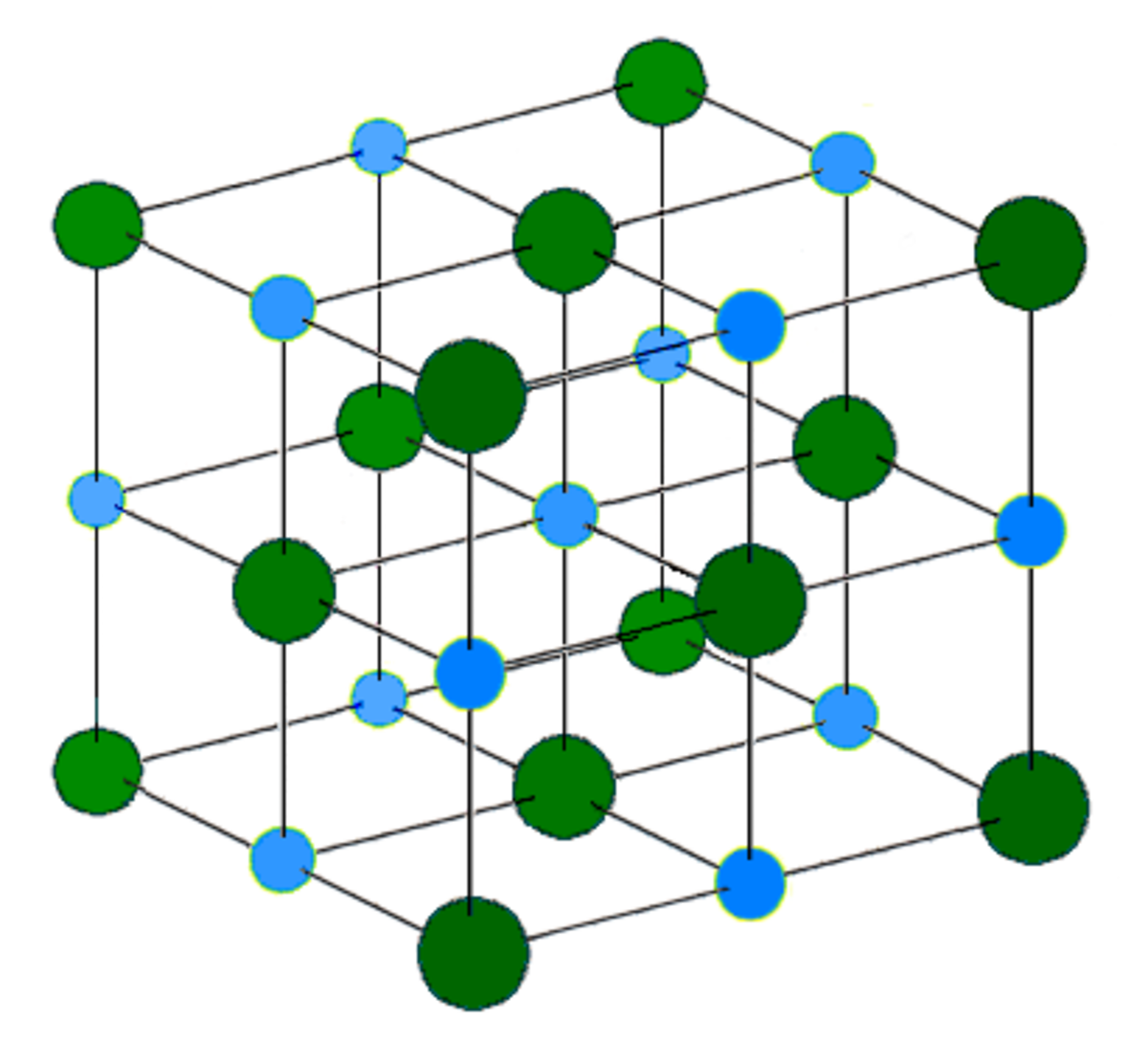
Le sel est un assemblage d'ions Na + et Cl − de maille cubique. Le sel est un cristal, car ses atomes forment une structure périodique et symétrique.
La structure du sel peut être décrite par le contenu de sa maille. Une maille de sel est un cube qui contient :
- un atome de chlore aux sommets de la maille (8 sommets chacun partagé parmi 8 mailles voisines)
- trois atomes de chlore au centre des faces de la maille (6 faces chacune partagée entre 2 mailles voisines)
- un atome de sodium au centre de la maille
- trois atomes sodium sur le milieu des arêtes de la maille (12 arêtes chacune partagée parmi 4 mailles voisines).
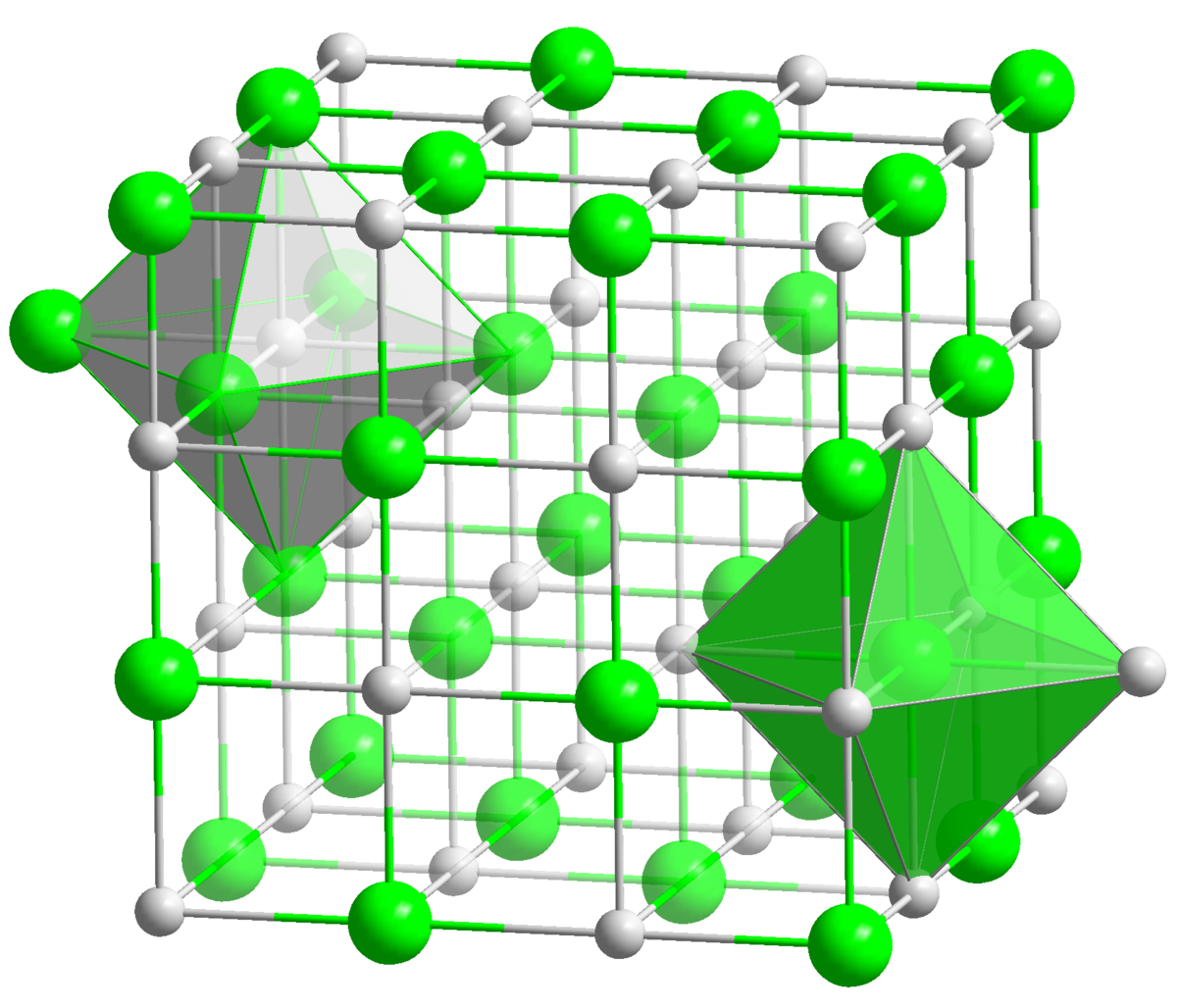
La structure du sel correspond au remplissage par les cations Na + d'une structure hôte composée par les anions Cl − . En effet, les anions Cl − forment un sous réseau cubique à faces centrées dans lequel les cations Na + occupent tous les sites octaédriques de la maille. Dans la structure du sel, les ions Na + et Cl − sont interchangeables. Il est aussi possible de dire que les cations Na + forment un sous réseau cubique à face centrée dans lequel les anions Cl − occupent tous les sites octaédriques de la maille.
La structure NaCl correspond à deux sous réseaux cubiques à face centrée d'ions, décalés de la moitié du côté de la maille selon l'une des directions des côtés de la maille.
La coordinence est le nombre de plus proches atomes voisins dans la structure. Tous les ions Na + et Cl − ont chacun dans le sel une coordinence 6, c'est-à-dire que n'importe quel ion Cl − est entouré de 6 ions Na + formant un octaèdre autour du Cl − . Et vice versa, autour de chaque ion Na + se trouvent comme plus proches voisins 6 ions Cl − formant aussi un octaèdre.