Loi de Dulong et Petit - Définition
En thermodynamique, la loi de Dulong et Petit stipule qu'à haute température, la capacité thermique molaire C de tout solide tend vers la valeur
-
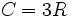
où R est la constante des gaz parfaits.
On peut également l'écrire en faisant apparaître la capacité thermique massique Cm et la masse molaire M du solide :
-
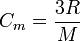
Ainsi cette valeur limite est la même pour tous les solides, ce qui est à peu près vérifié dans la pratique. Par contre, la façon dont la capacité thermique molaire tend vers cette valeur est différente d'un solide à l'autre. Pour expliquer son comportement, on utilise le modèle de Debye.

















































