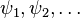Approximation orbitale - Définition
Un système chimique (molécules, ions...) est constitué de noyaux et d'électrons. Dans le cadre de l'approximation de Born-Oppenheimer, les électrons sont décrits collectivement par une fonction d'onde dite multiélectronique
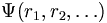
La fonction d'onde
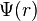
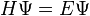
H est un opérateur appelé hamiltonien,
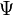
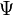
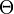
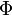
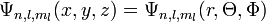
Les indices n, l et ml sont les trois nombres quantiques décrivant les orbitales atomiques de l'électron :
- n est le nombre quantique principal.
![n\in[0;\infty]\,](https://static.techno-science.net/illustration/Definitions/autres/c/c7321774a22834a4efec761445afb6ac_40b40a6f9c78f707e957589b3065a68c.png)
- l est le nombre quantique secondaire (ou azimuthal).
- ml est le nombre quantique tertiaire (ou magnétique).
L'approximation orbitale consiste à supposer que les électrons sont pratiquements indépendants les uns des autres, ce qui permet de simplifier l'écriture de la fonction d'onde :
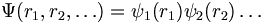
Mais cette approximation n'est pas satisfaisante car il existe des interactions entre le noyau chargé positivement et les électrons ainsi qu'entre les électrons eux-mêmes. Pour s'approcher des valeurs établies expérimentalement on utilise les règles de Slater qui permettent de moyenner pour chaque électron la charge effective : c'est le deuxième niveau d'approximation.
Chacune des fonctions d'onde