2-méthylpropan-2-ol - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| 2-méthylpropan-2-ol | |||
|---|---|---|---|
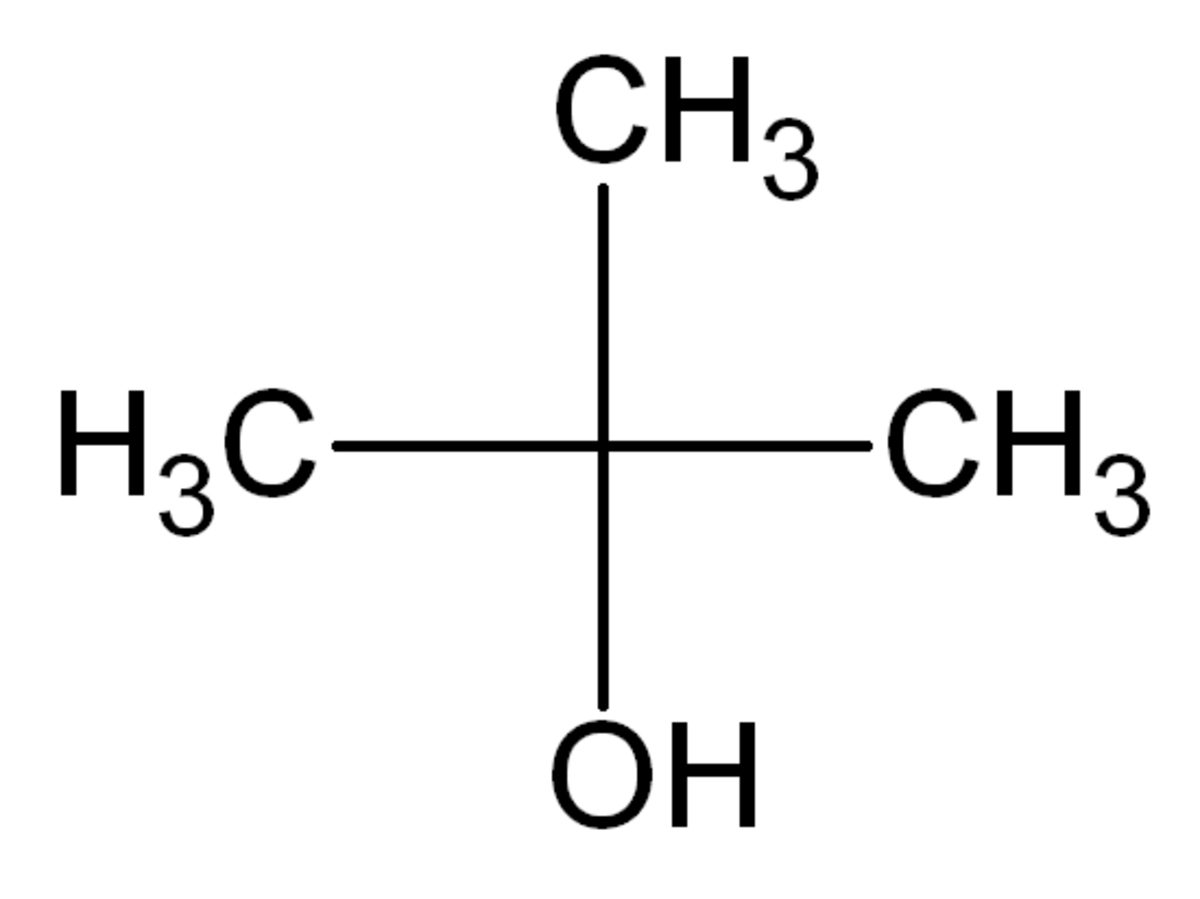
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | tert-butanol Alcool tert-butylique. | ||
| No CAS | |||
| No EINECS | |||
| Apparence | liquide incolore ou poudre cristalline, d'odeur caractéristique. | ||
| Propriétés chimiques | |||
| Formule brute | C4H10O | ||
| Masse molaire | 74,1216 ± 0,0042 g·mol-1 | ||
| Moment dipolaire | 1,66 D | ||
| Propriétés physiques | |||
| T° fusion | 25 °C | ||
| T° ébullition | 83 °C | ||
| Solubilité | dans l'eau : très bonne, Complète dans les solvants polaires et apolaires (acétone, éther). | ||
| Masse volumique | (eau = 1) : 0.8 | ||
| T° d’auto-inflammation | 470 °C | ||
| Point d’éclair | 11 °C (coupelle fermée) | ||
| Limites d’explosivité dans l’air | 2,4–8,0 %vol | ||
| Pression de vapeur saturante | à 20 °C : 4,1 kPa | ||
| Viscosité dynamique | 3,35 mPa*s (30 °C) | ||
| Point critique | 39,7 bar, 233,05 °C | ||
| Thermochimie | |||
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9,90 ± 0,02 eV (gaz) | ||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| Phrases R : 11, 20, | |||
| Phrases S : (2), 9, 16, | |||
| | |||
| |||
| | |||
|
3 2 0 | |||
| | |||


| |||
| | |||


Danger | |||
| Inhalation | Ébriété, nausée, vomissements | ||
| Peau | Irritation | ||
| Yeux | Irritation, irritation des muqueuses | ||
| Ingestion | Malaise, vomissements | ||
| Écotoxicologie | |||
| LogP | 0,4 | ||
| Seuil de l’odorat | bas : 3,3 ppm haut : 957 ppm | ||
| | |||
Le 2-méthylpropan-2-ol, méthylpropan-2-ol, ou tert-butanol, est un alcool tertiaire de formule brute C4H10O. C'est un des isomères du butanol. À température supérieure à 24,3 °C, c'est un liquide transparent soluble dans l'eau, l'éthanol et l'éther
Utilisation
Le 2-méthylpropan-2-ol est utilisé comme solvant, dans les dissolvants pour peintures, dans le carburant pour augmenter l'indice d'octane, et comme intermédiaire dans la synthèse d'autres produits chimiques communs comme les parfums.
Production et synthèse
Le 2-méthylpropan-2-ol peut être synthétisé industriellement par l'hydratation catalysée de l'isobutène.
Propriétés physico-chimiques
L'encombrement stérique du groupe tert-butyle rend le tert-butanol beaucoup moins nucléophile que les autres isomères du butanol. En outre, il n'est pas oxydable en cétone puisque le carbone central est quaternaire.
En présence d'une base forte, le tert-butanol perd un proton et devient un ion alcoolate. Par exemple, la déprotonation par l'hydrure de sodium :
- NaH + tBuOH → tBuO- + Na+ + H2