Diagramme de phase - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Un diagramme de phase est une représentation graphique utilisée en thermodynamique (voir Phase), généralement à deux ou trois dimensions, représentant les domaines de l'état physique (ou phase) d'un système (corps pur ou mélange de corps purs), en fonction de variables, choisies pour faciliter la compréhension des phénomènes étudiés.
Les diagrammes les plus simples concernent un corps pur avec pour variables la température et la pression ; les autres variables souvent utilisées sont l'enthalpie, l'entropie, le volume massique, ainsi que la concentration en masse ou en volume d'un des corps purs constituant un mélange.
Lorsque le système étudié est un mélange de n corps purs, son état physique est défini par les (n-1) proportions indépendantes de ses composants, ainsi que par la température et la pression. Ainsi, un diagramme à deux variables ne peut donc être établi qu'en fixant (n-1) variables du système.
C'est un diagramme associé à un équilibre qui ne permet pas de décrire un système dans un état métastable comme l'eau liquide à une température inférieure à 0 °C sous la pression atmosphérique normale (surfusion). Début 2009, tous les diagrammes de phases des éléments simples étaient établis sauf celui du bore, qui devrait être rapidement disponible suite à la synthèse réussie d'une nouvelle forme de bore dite « bore gamma » (partiellement ionique, mais forme la plus dure et dense du bore)
Diagramme d'un corps pur
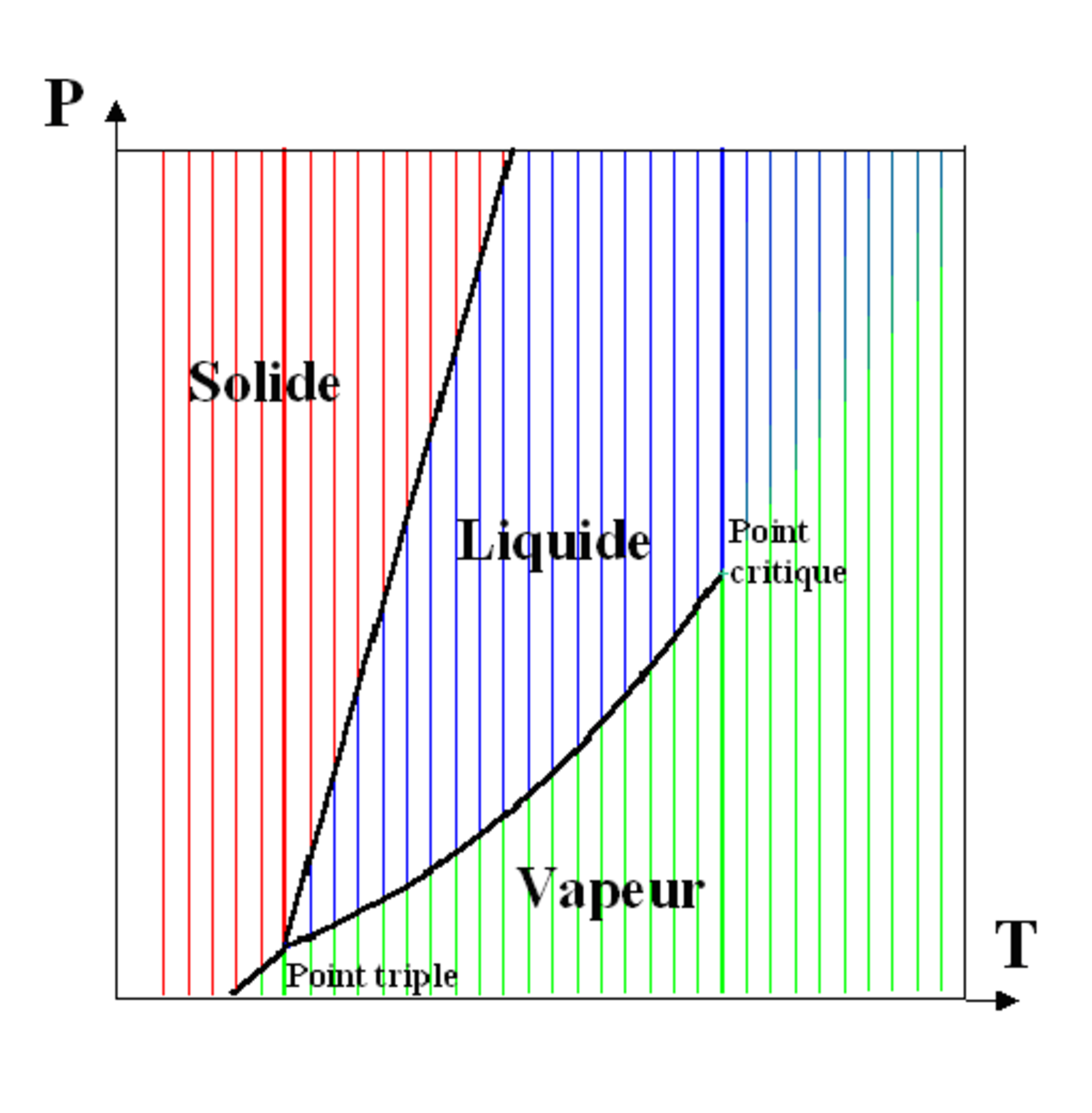
Un corps pur se présente sous une ou plusieurs de ses phases solides, liquide et gazeuse, en fonction des conditions de pression et de température. Généralement, un corps pur existe sous une seule phase pour une pression et une température données, sauf :
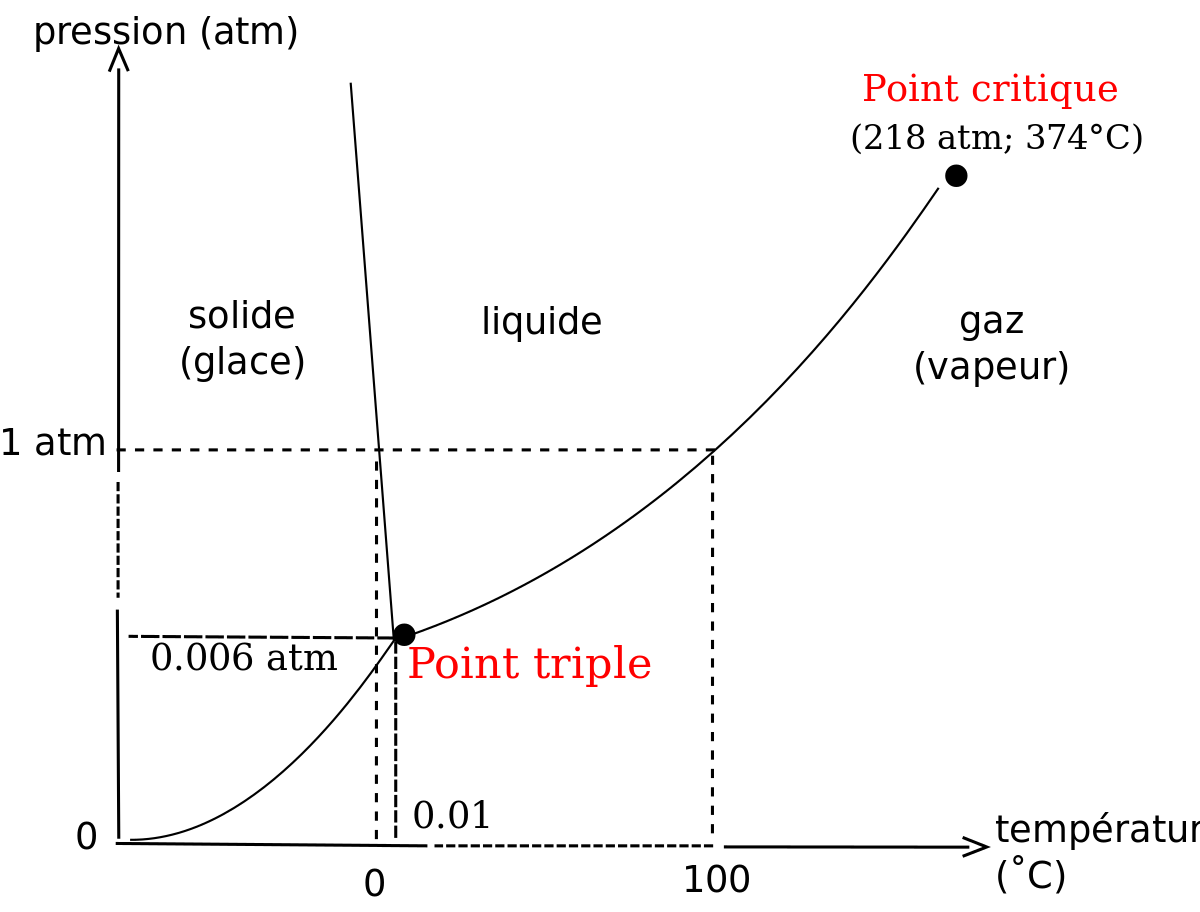
- au point triple, où les 3 phases coexistent à une température et une pression données ;
- pour un couple (pression, température) correspondant à un changement d'état (ou transition de phase) soit :
- entre 2 phases solides : transformation entre 2 variétés allotropiques ;
- entre une phase solide et une phase liquide : fusion - solidification ;
- entre une phase solide et une phase vapeur (gaz) : sublimation - condensation ;
- entre une phase liquide et une phase vapeur : vaporisation - liquéfaction ; la courbe de changement d'état liquide-vapeur s'interrompt en un point appelé point critique, au-delà duquel le corps ne présente plus qu'une seule phase fluide, plutôt proche (du point de vue de ses propriétés physiques) d'un gaz aux pressions inférieures à la pression critique, plutôt proche d'un liquide aux pressions supérieures à la pression critique.
Lorsque toutes les phases représentées correspondent à des états physiques différents, on parle parfois de diagramme de changement d'état.
En règle générale, les courbes de changement d'état sont croissantes dans le diagramme
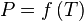
Remarques
- Un corps pur placé au contact de l'atmosphère n'est pas un système constitué d'un seul corps pur car il faut prendre en compte les gaz de l'air. Cela explique, par exemple, que l'eau coexiste habituellement à l'état liquide et à l'état de vapeur à la température ambiante, très éloignée de sa température d'ébullition (100 °C à la pression atmosphérique normale). En effet la pression partielle de vapeur d'eau est alors très inférieure à la pression atmosphérique. La pression de vapeur d'eau, appelée pression de vapeur saturante, de l'ordre de 0,006 atm à 0 °C, augmente progressivement jusqu'à 100 °C où elle atteint 1 atm. À ce stade la pression atmosphérique de l'air ne joue plus son rôle de couvercle et les molécules d'eau s'échappent brutalement du milieu: c'est le phénomène d'ébullition. Si l'on abaisse la pression de l'air par une pompe à vide, l'ébullition de l'eau peut même se produire à une température plus basse que la température ambiante.
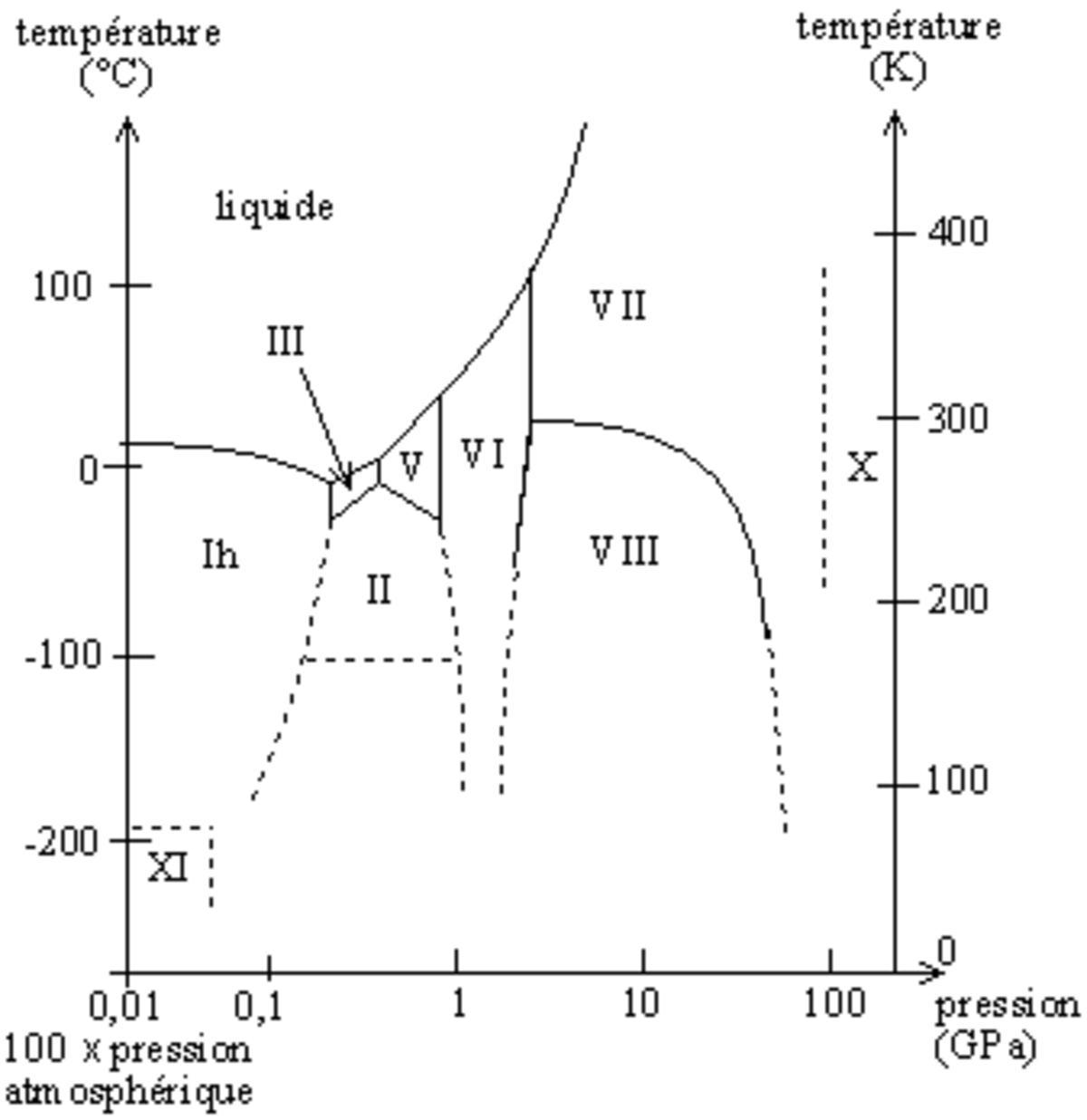
- À l'état solide, un corps peut parfois prendre plusieurs formes de cristallisation, selon le domaine de pression et de température. Chaque forme de cristallisation constitue ainsi une phase différente, ce qui permet de tracer un diagramme de phase.