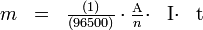Corrosion aqueuse - Définition
La liste des auteurs de cet article est disponible ici.
Corrosion par pile de concentration
La corrosion par pile de concentration est un cas très proche de la corrosion galvanique. La différence tient dans le fait qu'il y a corrosion sur une pièce de même métal. Il n'y a pas couplage de deux métaux de natures différentes. Seule la concentration du fluide qui baigne le métal varie en concentration.
Ce type de corrosion a lieu sur une même pièce. Elle a lieu lorsque la composition du milieu varie. En effet, le potentiel électrochimique est déterminé par le couple matériau/milieu, il suffit que l'un des deux varie pour que le potentiel varie. Par exemple, si une pièce dans un courant d'eau présente une cavité, l'eau dans cette cavité stagne et sa composition évolue avec les réactions chimiques d'oxydo-réduction ; par ailleurs, l'eau à l'extérieur de la cavité est continuellement renouvelée et garde la même composition, on peut donc avoir une pile qui se crée entre la cavité et l'extérieur de la pièce, donc une corrosion accélérée.
On voit ici qu'une même pièce se comportera de manière différente en eau stagnante et en eau mouvante. Si une canalisation présente un coude franc, le liquide à l'extérieur du coude est moins agité, il stagne, tandis que le liquide à l'intérieur du coude est agité, ce qui peut aussi produire une pile.
Corrosion par aération différentielle
Généralités
La corrosion par aération différentielle se produit lorsqu'un même matériau est en contact avec deux milieux de teneurs en oxydant différentes. Par exemple, si un piquet est planté dans la terre ou la vase, la partie proche de la surface est en contact avec plus de dioxygène que la partie profonde, il peut donc se créer une pile entre la partie profonde et la partie en surface. La corrosion par aération différentielle se rencontre aussi pour les pièces immergées, lorsque la concentration en dioxygène évolue avec la profondeur. C'est parfois le cas des coques de bateaux. La couche d'eau proche de la surface est plus riche en oxygène que les couches profondes. Il peut y avoir corrosion au niveau de la ligne de flottaison.
Le problème d'aération différentielle peut se poser lorsqu'une pièce n'est peinte qu'en partie, ou lorsque la peinture est rayée.
L'effet Evans
L'existence de la corrosion par aération différentielle a été démontrée en réalisant l'expérience suivante :
Deux électrodes en acier strictement identiques sont plongées dans un bain salin (avec du chlorure de sodium par exemple). Ce bain est séparé en deux moitiés par une céramique qui laisse passer les ions mais pas les molécules. Comme pour une pile, les deux électrodes sont reliées par un conducteur électrique. Dans une moitié du bain, on fait barboter de l'oxygène et dans l'autre de l'azote. Un courant électrique apparaît alors, la cathode étant du côté où l'eau est plus riche en oxygène.
Corrosion galvanique (pile électrochimique)
Généralités
Une pile électrochimique est créée lorsque deux métaux de natures différentes sont mis en contact. Un des métaux s'oxyde et se dissout (anode), tandis que sur l'autre métal a lieu une réduction (cathode), et éventuellement formation d'une couche de produits de réaction (des espèces chimiques de la solution se réduisent et se déposent, notamment dépôt calco-magnésien). On parle de corrosion galvanique. Ce phénomène explique :
- le principe de la « protection cathodique par anode sacrificielle » : on crée une pile électrochimique qui impose un sens de parcours aux électrons pour empêcher la réaction de corrosion ; l'anode se dissout (elle est sacrifiée) et la cathode reste stable, elle est de plus parfois protégée par une couche de produits de réaction ;
- le principe de la « protection cathodique par courant imposé » : à la place de l'anode sacrificielle, on peut imposer le sens de parcours des électrons en établissant une différence de potentiel entre la pièce et le milieu avec un générateur de tension, par exemple alimenté par des panneaux solaires ;
- pourquoi lorsque l'on met deux métaux différents en contact, l'un se corrode très rapidement.
C'est exactement le même type de réactions chimiques qui ont lieu dans une pile d'alimentation électrique, une batterie ou un accumulateur.
Principe
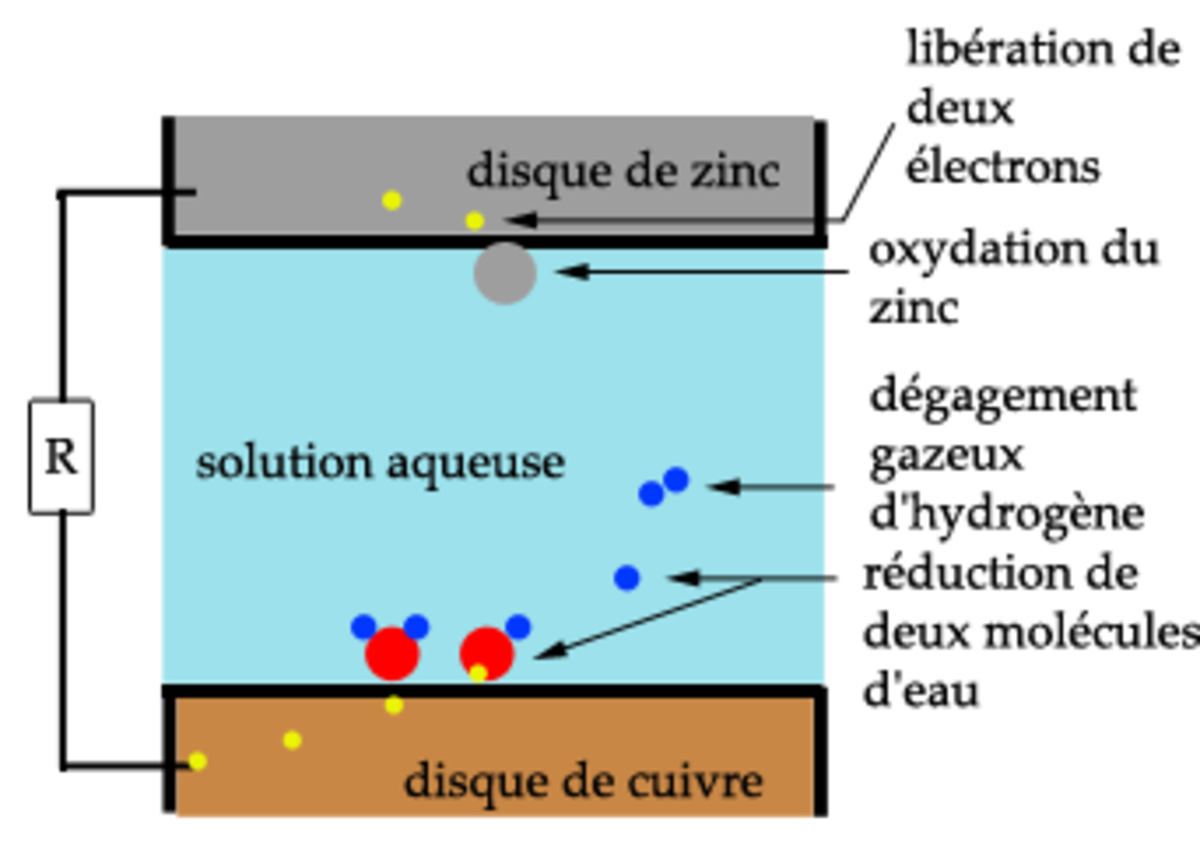
Pour avoir une corrosion galvanique, trois conditions sont nécessaires :
- Des métaux de nature différentes : C'est la différence de potentiel de dissolution entre les deux métaux qui provoque le phénomène. L'expérience montre qu'il faut une différence de potentiel de 100 mV pour voir apparaître la corrosion.
- La présence d'un électrolyte en général aqueux : La présence d'ions dans le milieu aqueux (exemple : eau de mer), accélère le phénomène. Ce type de corrosion peut également exister dans un milieu anhydre mais ionique comme l'ammoniaque liquide.
- La continuité électrique entre les deux métaux : Le phénomène diminue très rapidement en éloignant les deux métaux. Il faut qu'il y ait transfert de charges électriques pour avoir le phénomène de corrosion.
La masse de métal consommé est donnée par la loi de Faraday :
- m: masse (g)
- A : masse atomique du métal
- n : valence (exemple : 3 pour l'aluminium)
- I : intensité électrique (A)
- t : temps (s)
L'intensité est fonction de :
- La nature de l'électrolyte : elle augmente si le milieu est salin,
- polarisation : certains produits de corrosion peuvent faire obstacle et ralentir ou bloquer les réactions chimiques,
- la surface relative de la cathode et de l'anode. On peut établir le ratio suivant :
K augmente si la surface de la cathode augmente et/ou la surface de l'anode diminue. La corrosion galvanique sera donc très importante si l'on a une grande cathode et une petite anode.
Exemple : cas des boîtes de conserve en tôle d'acier étamé
Une tôle étamée (fer-blanc) est une tôle d'acier sur laquelle a été appliquée une fine couche d'étain (Sn) pour la protéger.
Le revêtement peut présenter de légères discontinuités.
En présence d'eau le potentiel de dissolution du couple Fe2+/Fe est plus faible que celui du couple Sn2+/Sn. Il y a donc une très petite anode (Fe) et une très grande cathode (Sn) ce qui entraîne une corrosion galvanique rapide et une perforation de la boîte de conserve.
En présence d'acide citrique (fréquent dans les liquides alimentaires) par complexation de différents éléments chimiques, la position relative des couples Fe2+/Fe et Sn2+/Sn s'inverse.
Il y a donc dans ce cas une grande anode (Sn) et une petite cathode (Fe), et dissolution par corrosion de l'étain. Mais compte tenu du rapport de surface, cette dissolution est extrêmement lente et sur une très grande surface, ce phénomène assurant la durabilité de la boîte de conserve.