Acide citrique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acide citrique | ||
|---|---|---|
| ||
| Général | ||
| Nom IUPAC | ||
| Synonymes | acide 2-hydroxy-1,2,3-propanetricarboxylique | |
| No CAS | (anhydre) (monohydrate) | |
| No EINECS | ||
| PubChem | ||
| No E | E330 | |
| FEMA | ||
| SMILES | ||
| InChI | ||
| Apparence | cristaux incolores. (anhydre). cristaux blancs, faiblement deliquescents. (monohydrate) | |
| Propriétés chimiques | ||
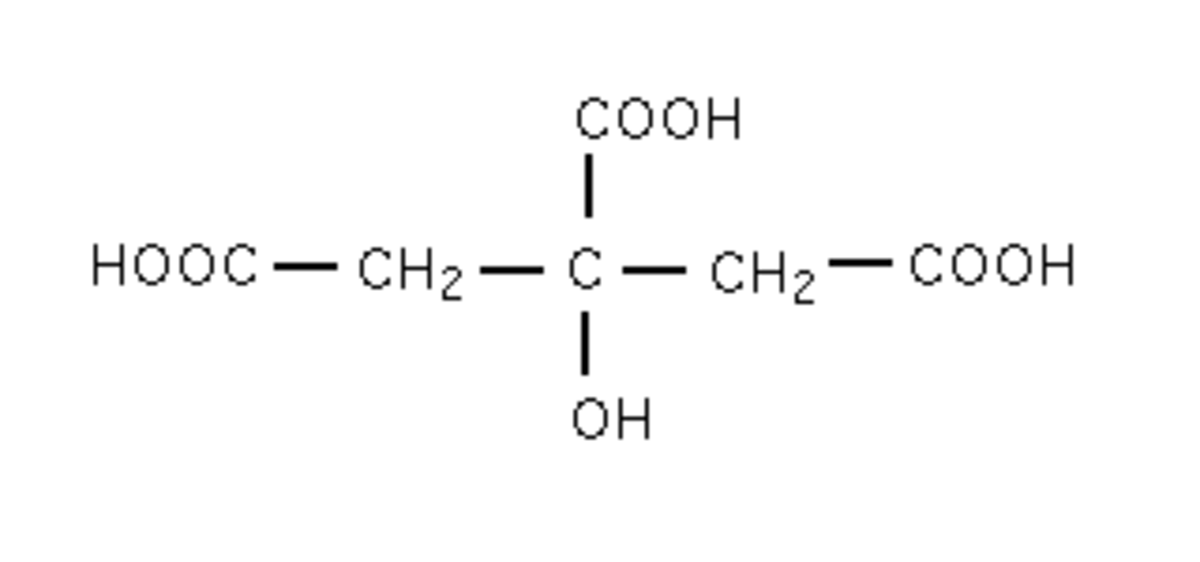
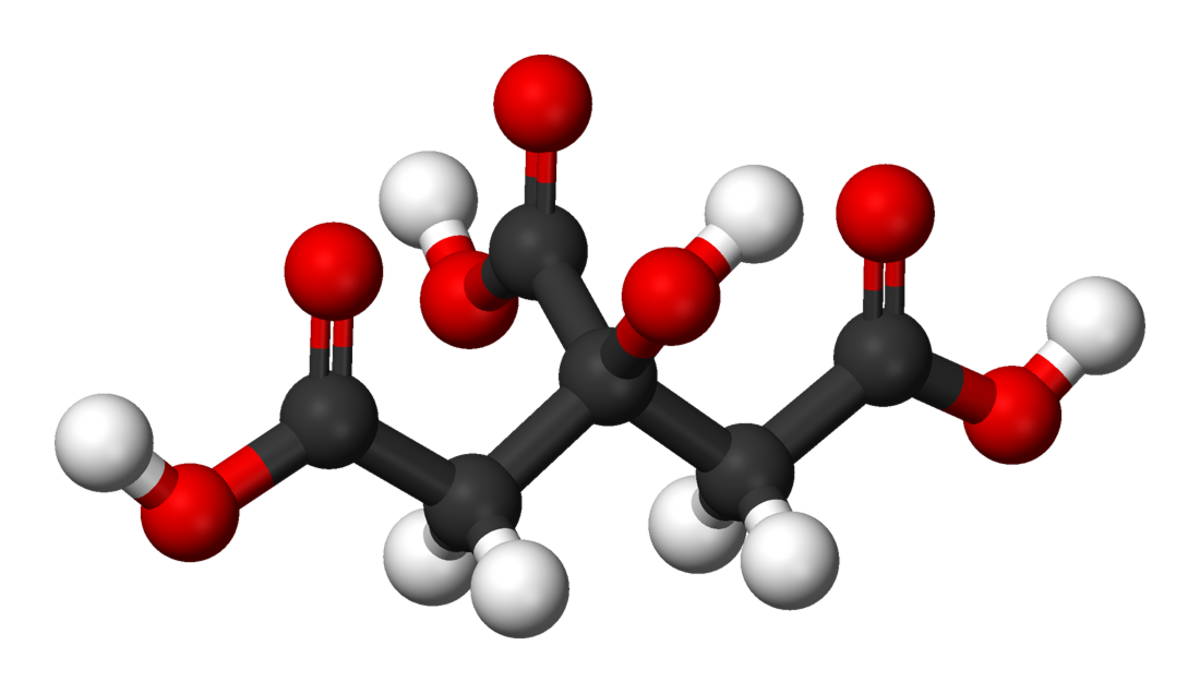
| Formule brute | C6H8O7 | |
| Masse molaire | 192,1235 ± 0,0075 g·mol-1 | |
| pKa | 3,13 4,76 6,40 | |
| Propriétés physiques | ||
| T° fusion | 426 K (153 °C) | |
| T° ébullition | Se décompose au-dessous du point d'ébullition à 175 °C | |
| Solubilité | Soluble dans l'eau 592 g·l-1 à 20 °C). Soluble dans l'éther, l'acétate d'éthyle; insoluble dans le benzène, le chloroforme. | |
| Masse volumique | 1,665 g·cm-3 (20 °C) | |
| T° d’auto-inflammation | 1 010 °C | |
| Point d’éclair | 100 °C | |
| Limites d’explosivité dans l’air | 0,28–2,29 %vol | |
| Thermochimie | ||
| Cp | ||
| Cristallographie | ||
| Classe cristalline ou groupe d’espace | P21/a | |
| Paramètres de maille | a = 12,817 Å b = 5,628 Å | |
| Volume | 770,94 Å3 | |
| Densité théorique | 1,655 | |
| Précautions | ||
| | ||
| ||
| Phrases R : 36, | ||
| Phrases S : 26, | ||
| | ||
Acide citrique :
Acide citrique monohydraté : 
| ||
| Inhalation | Toux. Essoufflement. Mal de gorge. | |
| Peau | Rougeur. | |
| Yeux | Rougeur. Douleur. | |
| Ingestion | Douleurs abdominales. Mal de gorge. | |
| autre | Combustible. Les particules finement dispersées forment des mélanges explosifs dans l'air. | |
| Écotoxicologie | ||
| LogP | -1,7 | |
| | ||
L'acide citrique est un triacide carboxylique de formule C6H8O7.
Description
L'acide citrique joue un rôle central dans le métabolisme de tous les organismes vivants.

L'acide citrique est naturellement présent dans le citron en grande quantité (il intervient pour plus de 95 % dans l'acidité de ce fruit). C'est en fait un intermédiaire du métabolisme des organismes aérobies, et c'est aussi l'autre nom du cycle de Krebs (cycle de l'acide citrique). Il est formé, au cours de ce cycle, par condensation d'acétyl-CoA et d'oxaloacétate, par la citrate synthétase. L'homme, par exemple, en produit environ 2 kilogrammes par jour, qui sont décomposés immédiatement.
L'acide citrique est biodégradable et n'est pas toxique pour l'homme ni pour l'environnement. Cependant, il est irritant et peut provoquer des brûlures s'il entre en contact prolongé avec des muqueuses : il doit donc être utilisé avec quelques précautions (port de gants notamment).
La dissociation de l'acide citrique se fait en trois étapes réversibles.