Furane - Définition
La liste des auteurs de cet article est disponible ici.
Aromaticité
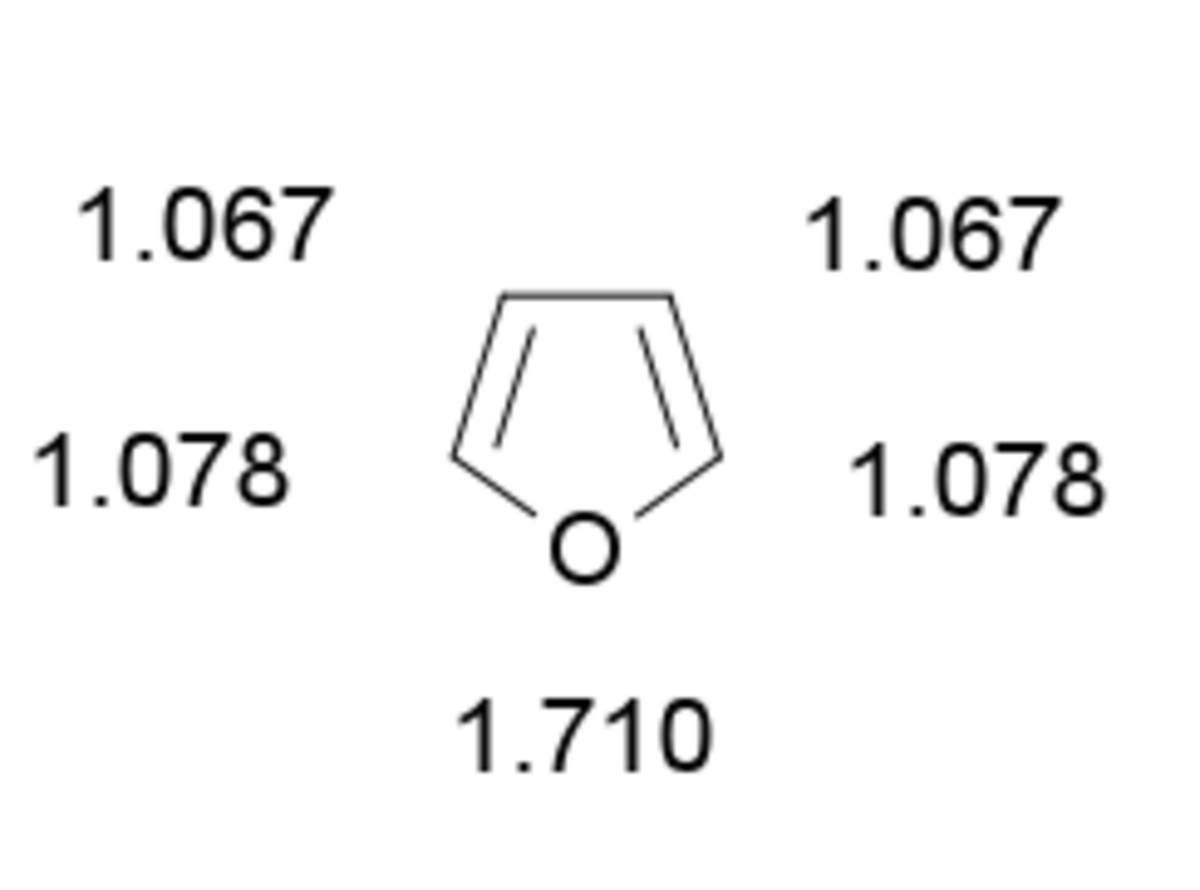
Le furane est un composé aromatique qui respecte la règle de Hückel. Le furane comporte six électrons délocalisés : quatre apportés par les doubles liaisons et deux pour l'atome d'oxygène (un des deux doublets non liants). Chaque carbone apporte un de ses électrons pi dans la délocalisation et l’oxygène apporte deux électrons. Les carbones sont hybridés sp². Le furane possède une énergie de résonance entre 62,3 et 96,2 kJ par mole. Cette énergie est inférieure à celle du benzène, du thiophène et du pyrrole. Le furane est un composé moins aromatique que le benzène, le pyrrole et le thiophène. Cette faible aromaticité explique que le furane agit comme un diène cyclique dans certaines réactions de Diels-Alder.
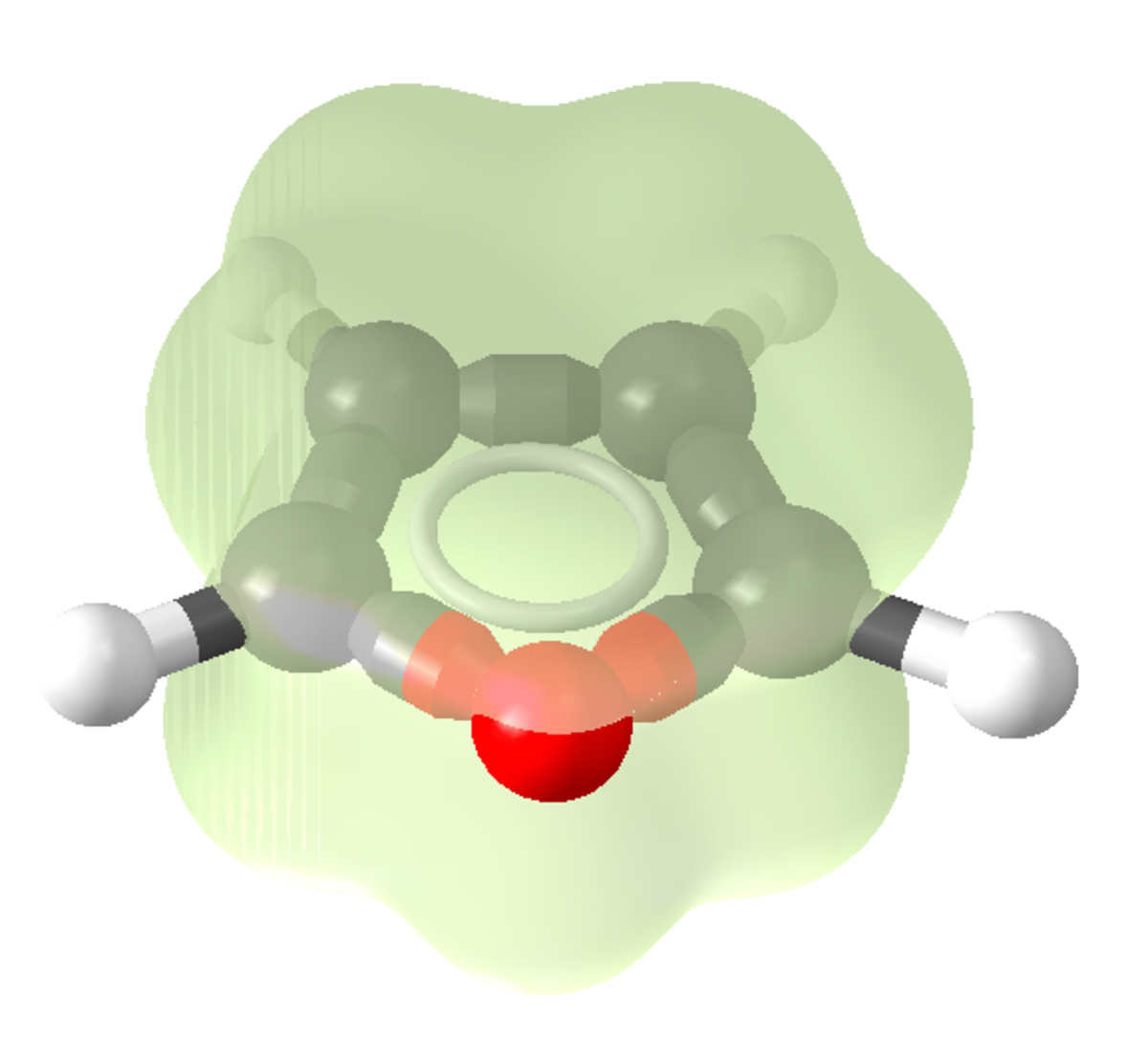
L'atome d'oxygène a un effet mésomère donneur et un effet inductif attracteur dans le furane. La délocalisation du doublet libre constitue l'effet mésomère de l'oxygène tandis que l'attraction des électrons des liaisons C-O vers l'atome d'oxygène correspond à l'effet inductif. Le caractère inductif attracteur influence la répartition des électrons dans le cycle mais ne parvient pas à contrebalancer l'effet mésomère. L’oxygène apporte donc globalement une densité électronique supplémentaire dans le cycle. Cette contribution électronique de l'oxygène se traduit par des valeurs de densité électronique supérieures à 1 pour les carbones du cycle. L'effet mésomère donneur engendre une charge positive sur l'oxygène dans les quatre formes mésomères du furane et une charge négative délocalisée sur les carbones du cycle.
L'atome d'oxygène possède un autre doublet qui n'est pas délocalisé . Le furane est un composé plan. De même que ses homologues thiophène ou pyrrole, il est un cycle électro-excédentaire. Il a en effet 6 électrons pi répartis sur 5 atomes ; la densité électronique est donc nettement plus importante que sur les analogues benzéniques. D'autre part, contrairement aux cycles aromatiques simples à six chainons, seule une de ses formes de résonance est neutre, les autres existant sous forme zwittérionique. Ces formes chargées étant minoritaires, la chimie du furane tiendra en partie de celle des aromatiques et en partie de celle des diènes.
Propriétés physico-chimique
Le furane est un liquide incolore aux condition normale de pression et de température. Le furane est très volatil et possède une faible température d'ébullition. En RMN du proton, le furane présente deux massifs de pics dans le chloroforme deutéré : 7,4 ppm pour les hydrogènes en α de l’oxygène, 6,3 ppm pour les hydrogènes en β. En RMN du carbone, le furane présente deux pics : à 142 ppm pour les carbones 1 et 5, 109 ppm pour les carbones 2 et 4. Le furane est très soluble dans l'acétone, soluble dans le méthanol et dans l'éther diéthylique et très peu soluble dans l'eau. L'indice de réfraction est de 1.421.
Réaction avec les acides
Les acides minéraux en solution diluée aqueuse, à froid, n'affectent pas le furane ou les alkylfuranes.. mais à chaud, ils protonnent le furane en position 2, produisant une ouverture du furane et la formation de composé dicarbonylés. De plus, les acides forts concentrés (l'acide sulfurique, l'acide nitrique fumant) ou les acides de Lewis provoquent une polymérisation du furane et de ses dérivés alkyles.
Les substituants du furane influencent la réactivité vis-à-vis des acides. Les furanes substitués par des groupements électroattracteurs sont relativement stables en milieu acide car le cycle y est moins chargé en électrons et donc moins réactif. Par contre, les furanes substitués par des groupements électrodonneurs sont facilement ouverts ou polymérisés en milieu acide. En effet, les substituants électrodonneurs facilitent l'attaque d'un proton en position 2 du furane.