Furane - Définition
La liste des auteurs de cet article est disponible ici.
Réactivité du furane
Les différents types de réactivité
en tant qu'aromatique
Le furane étant électro-excédentaire, les réactions de substitution électrophile aromatique sont nettement plus rapides que sur les analogues benzéniques. Ainsi, il est possible de réaliser les réactions d'halogénation, de sulfonation, de métalation, ... notons par exemple que le furane est tellement réactif qu'il peut subir des acylations de Friedel et Crafts sans même la présence de catalyseur.
Les positions les plus favorables pour les réactions de substitution sont les position 2 et 5 (en alpha de l'oxygène). Lorsque les deux sont disponibles, il est assez difficile de s'arrêter à la monosubstitution. Lorsque les positions 2 et 5 sont occupées, les réactions ont lieu sur les positions restantes.
en tant que diène
Le furane et ses dérivés peuvent réagir en tant que diènes ou bien en tant que composés aromatiques selon les substituants sur le cycle. Le furane non substitué réagit particulièrement bien en tant que diène dans les réactions de cyclisation de type Diels-Alders à cause de sa faible aromaticité. De même les alkyles-furanes, les alkoxy-furanes et les ester et éther furfuryliques ont une bonne réactivité dans les réactions de Diels-Alder. Cependant les acides furoiques, les nitrofuranes et le furfural possèdent des groupements électroattracteurs et ne réagissent pas même avec des diénophiles forts. Il peut réagir avec l'anhydride maléique, le maléate et le fumarate sous haute pression, l'acrylate avec un catalyseur (l'iodure de zinc).
L'hydrogénation totale du furane donne le tétrahydrofurane (THF), solvant fortement utilisé en chimie organique et pharmaceutique.
en tant qu'éther
Le furane est un éther cyclique. Il est particulièrement sensible aux ouvertures en milieu aqueux acide. C'est notamment la source de réactions secondaires, notamment sur les dérivés halogénés, particulièrement instables.
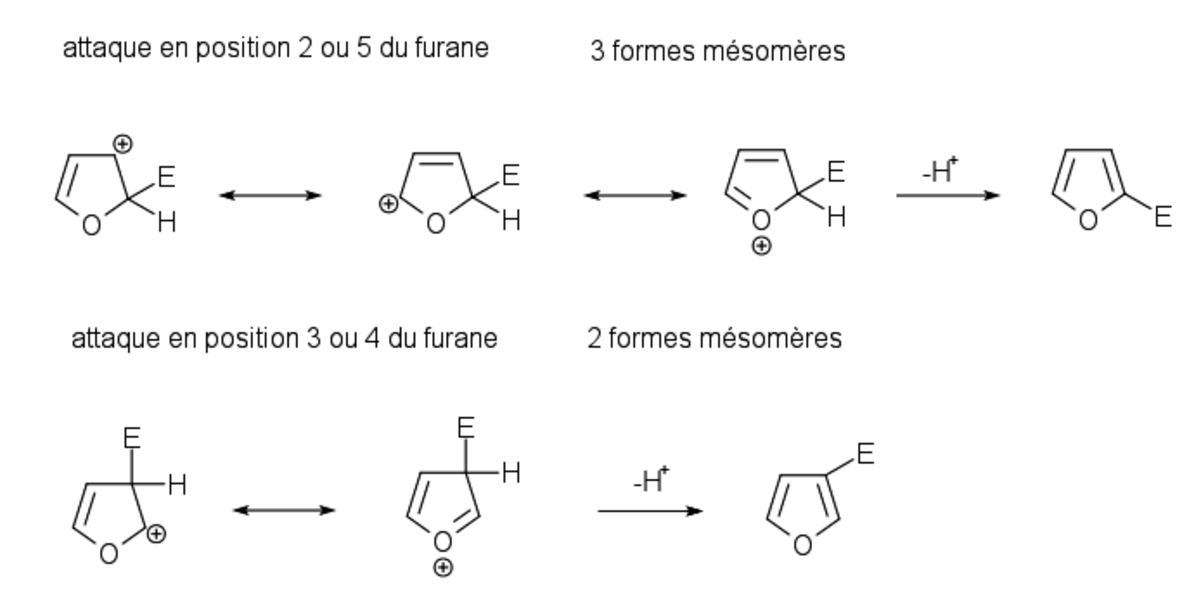
Régiosélectivité des substitutions
La position où va s’effectuer une substitution dépend de la stabilité de l’intermédiaire de la réaction. L’écriture des formes mésomères des intermédiaires d’une substitution électrophile sur le furane montre qu’une substitution s’effectue préférentiellement en position 2 ou 5 car l'intermédiaire formé possède 3 formes mésomères. Lorsque la substitution s'effectue en position 3 ou 4, l'intermédiaire formé possède seulement deux formes mésomères et a une stabilité moins grande.
L'écriture des formes mésomères permet de situer les charges partielles négatives du furane dans les position 2,3,4,5. Parmi les formes mésomères, la forme non chargée est plus représentative car plus stable. Parmi les formes mésomères avec des charges, celles où les charges sont les plus éloignées sont plus représentatives que les formes où les charges sont proches. Le furane possède une seule forme mésomère non chargée contrairement au benzène qui possède deux formes mésomères non chargées.
Substitution électrophile aromatique
Le furane est plus réactif que le thiophène et le benzène vis-à-vis des réactifs électrophiles mais moins réactif que le pyrolle.
La nitration du furane est effectuée avec de l'anhydride acétique et de l'acide nitrique à basse température. Le 2-nitrofurane est formé, puis si la réaction continue, du 2,5-dinitrofurane se forme. La nitration forme un composé non-aromatique, isolable qui peut perdre une molécule d'acide acétique par l'action d'une base comme la pyridine ou par solvolyse.
La sulfonation est réalisée à température ambiante par l'action du complexe pyridine-trioxyde de soufre pour conduire à un composé mono sufonate.
L'alkylation dans les conditions de Friedel Craft n'est pas possible et conduit à un mélange de produits et à des polymères. Cependant, le furane est acylé en présence d'un acide de Lewis par des chlorures d'acide ou des anhydrides. La substitution se fait en position 2. La réaction de Vilsmeier-Haack permet d'ajouter un groupement formyle en position 2 du furane. La réaction ne Mannich ne fonctionne pas avec le furane mais s'applique aux alkyles furane qui possèdent une position 2 ou 5 libre.