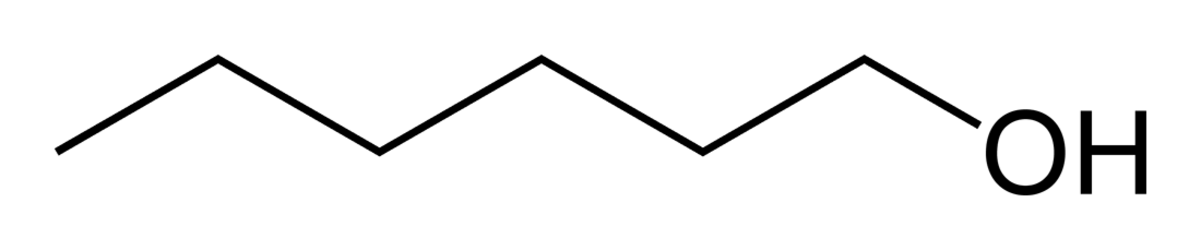
Hexan-1-ol - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| hexan-1-ol | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | hexanol 1-hexanol n-hexanol alcool hexylique | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | Liquide incolore d'odeur caractéristique | ||
| Propriétés chimiques | |||
| Formule brute | C6H14O | ||
| Masse molaire | 102,1748 ± 0,0061 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | -44,6 °C | ||
| T° ébullition | 157 °C | ||
| Solubilité | 5,9 g·l-1 (eau,20 °C) | ||
| Masse volumique | 0,82 g·cm-3 à 20 °C | ||
| T° d’auto-inflammation | 290 °C | ||
| Point d’éclair | 63 °C | ||
| Limites d’explosivité dans l’air | 1,1 - 7 Vol%. | ||
| Pression de vapeur saturante | 0,93 mbar à 20 °C 2,0 mbar à 30 °C 8 mbar à 50 °C | ||
| Point critique | 337,35 °C, 34,2 bar, 0,387 l·mol-1 | ||
| Thermochimie | |||
| S0 | 439,7 J·K-1·mol-1 | ||
| S0 | 287,4 J·K-1·mol-1 | ||
| ΔH0 | -316 kJ·mol-1 | ||
| ΔH0 | -377,5 kJ·mol-1 | ||
| ΔH° | 15,38 kJ·mol-1 à -47,35 °C | ||
| ΔH° | 61,61 kJ·mol-1 | ||
| Cp | 243,2 J·K-1·mol-1 (liquide,25 °C) | ||
| PCI | -3 984,37 kJ·mol-1 (liquide) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 22, | |||
| Phrases S : 2, 24/25, | |||
| | |||
| |||
| | |||
|
2 3 0 | |||
| | |||


| |||
| Écotoxicologie | |||
| DL | 1,95 g/kg (souris, oral) 103 mg/kg (souris, i.v.) | ||
| CL | 1060 ppm (souris, 6h) | ||
| LogP | 2,03 | ||
| | |||
L'hexan-1-ol est un alcool primaire de formule brute C6H14O et est un des isomères de l'hexanol. Il s'agit d'un liquide incolore peu soluble dans l'eau mais miscible dans l'éther et dans l'éthanol. Son odeur s'apparente à celle de l'herbe coupée et est utilisé dans l'industrie de la parfumerie.
Production et synthèse
L'hexan-1-ol est produit industriellement par oligomérisation de l'éthylène dans le triéthylaluminium suivit d'une oxydation de de l'organométallique obtenue. Cette synthèse est inspiré des travaux du chimiste allemand Karl Ziegler. On a idéalement:
- Al(C2H5)3 + 6C2H4 → Al(C6H13)3
- Al(C6H13)3 + 1½O2 + 3H2O → 3HOC6H13 + Al(OH)3
Le processus donne naissance à une série d'oligomères qui sont ensuite séparés par distillation.
Une autre méthode de préparation consiste en l'hydroformylation du pent-1-ène suivit d'une hydrogénation de l'aldéhyde formé. Cette synthèse est utilisée industriellement pour produire des mélanges d'isomères qui constituent des précurseurs de plastifiants.
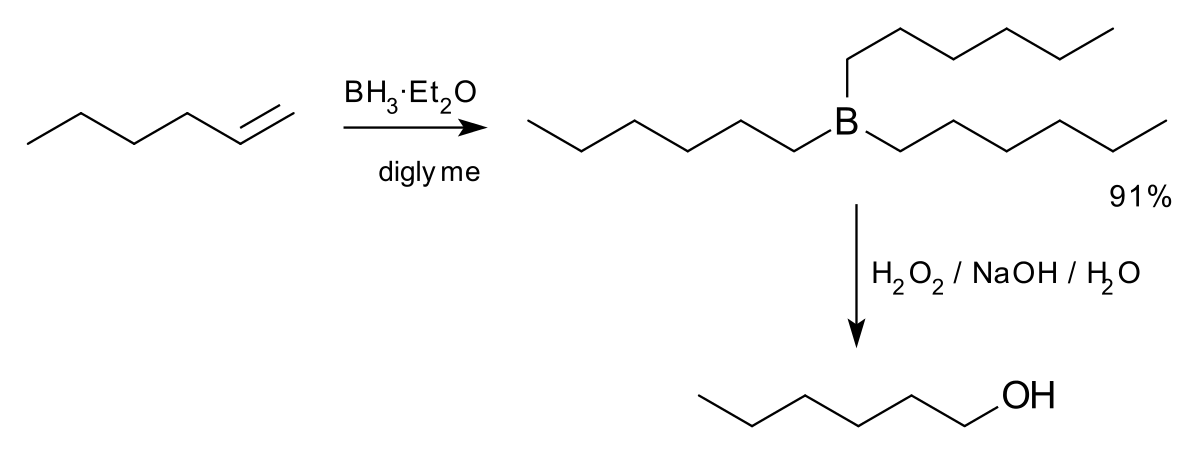
En principe, l'hex-1-ène peut être transformé en hexan-1-ol par hydroboration dans du tétrahydrofurane:
Cependant, cette méthode est peu utilisée industriellement car plus couteuse que l'oligomérisation.