Tétrahydrofurane - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Tétrahydrofurane | |||
|---|---|---|---|
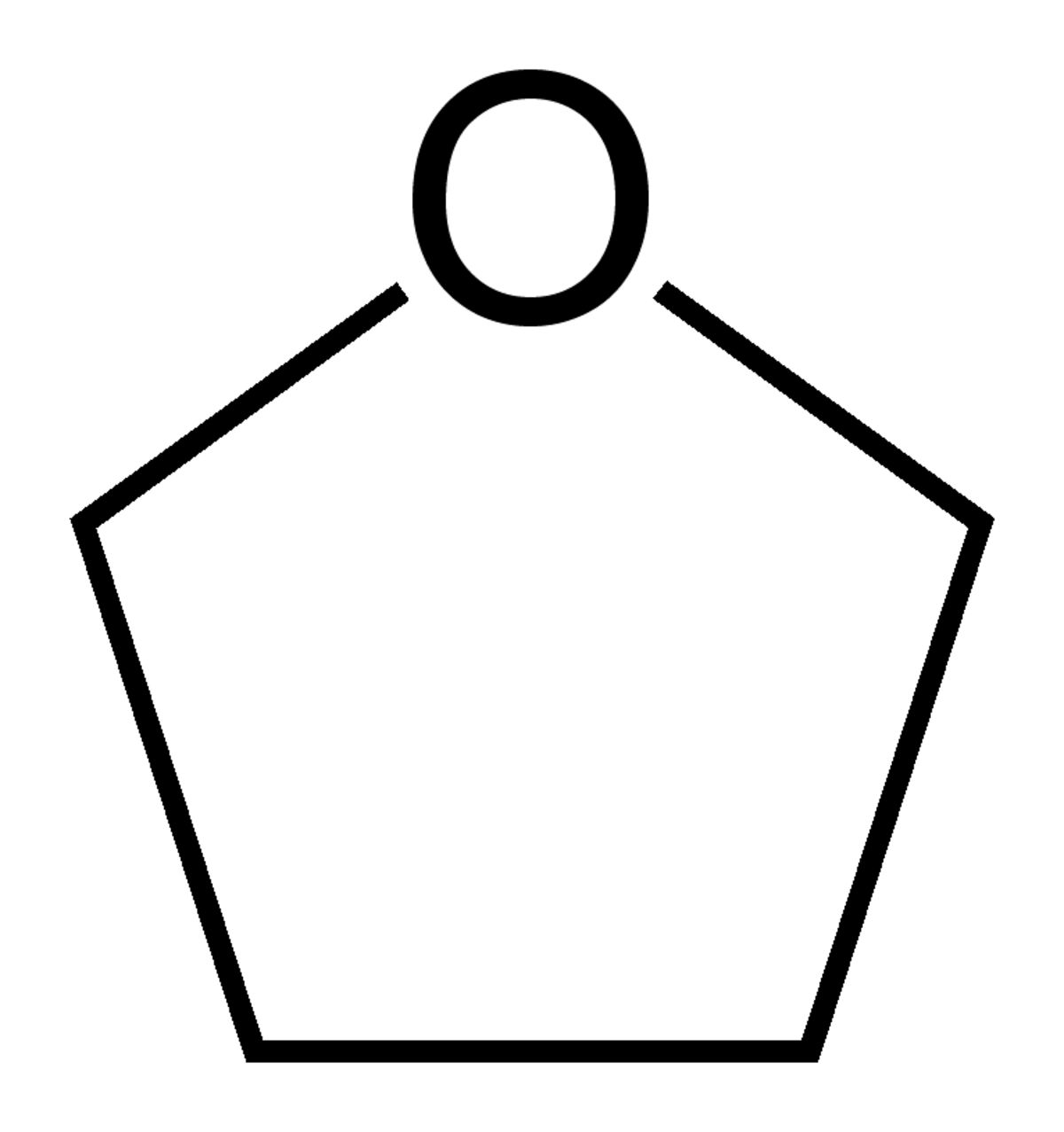
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | Oxolane, tétrahydrofurane THF | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, d'odeur caractéristique. | ||
| Propriétés chimiques | |||
| Formule brute | C4H8O | ||
| Masse molaire | 72,1057 ± 0,0041 g·mol-1 | ||
| Moment dipolaire | 1,75 ± 0,04 D | ||
| Diamètre moléculaire | 0,504 nm | ||
| Propriétés physiques | |||
| T° fusion | -108,5 °C | ||
| T° ébullition | 66 °C | ||
| Solubilité | dans l'eau : miscible | ||
| Masse volumique | 0,89 g·cm-3 | ||
| T° d’auto-inflammation | 321 °C | ||
| Point d’éclair | -14,5 °C (coupelle fermée) | ||
| Limites d’explosivité dans l’air | 2–11,8 %vol | ||
| Pression de vapeur saturante | à 20 °C : 19,3 kPa | ||
| Point critique | 51,9 bar, 266,95 °C | ||
| Thermochimie | |||
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9,38 ± 0,05 eV (gaz) | ||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| Phrases R : 11, 19, 36/37, | |||
| Phrases S : 2, 16, 29, 33, | |||
| | |||
| |||
| | |||
|
3 2 1 | |||
| | |||


| |||
| | |||


Danger | |||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 0,09 ppm haut : 61 ppm | ||
| | |||
Le tétrahydrofurane (ou 1,4-époxybutane ou oxolane ou oxacyclopentane ou encore oxyde de tétraméthylène), appelé souvent plus simplement THF, est un composé organique hétérocyclique. C'est un des éthers les plus polaires et il est utilisé en synthèse organique comme solvant de polarité moyenne. Il a une température d'ébullition plus grande que la plupart des éthers (T = 66 °C). Il est narcotique et toxique (VME 150 mg·m-3). On peut l'obtenir par déshydratation du butan-1,4-diol. Il est difficile de le conserver sec car il est relativement miscible à l'eau.
Purification : élimination des peroxydes dangereux
En outre, il a tendance à former des peroxydes lors du stockage (comme tous les éthers) : il convient donc de tester la présence de peroxydes et le cas échéant de les éliminer avant tout usage car ce sont des composés particulièrement explosifs. Pour cela, on prélève un petit volume de THF à tester et on l'agite avec une solution acidifiée d'iodure de potassium à 10% : si le test est positif (coloration jaune), il faut alors détruire les peroxydes en agitant la totalité du THF avec 1/5 de son volume d'une solution de disulfite de sodium à 5%. On refait le test et l'on recommence si nécessaire le lavage au disulfite de sodium jusqu'à ce que le test soit négatif.
Cette précaution est indispensable avant tout usage du THF et en particulier avant la distillation, opération qui est souvent pratiquée à des fins de purification juste avant l'emploi d'un solvant : en effet, à la fin de la distillation, les résidus seront constitués presque exclusivement de ces peroxydes, lesquels vont s'échauffer et exploser. Une bonne méthode pour éviter ce phénomène est de distiller le THF sous atmosphère inerte (azote ou argon) et sur sodium et benzophénone - (C6H5)2CO -. Celle-ci forme avec le sodium un radical qui réagit avec les peroxydes de THF, l'eau et l'oxygène présents dans le THF et les élimine, produisant ainsi par distillation un THF pur, sec et désoxygéné. De plus le radical, (C6H5)2C∙-O−, possède une belle couleur violet profond qui quand elle est observée, garantit que tous les peroxydes, eau et O2 ont été éliminés.





















































