Indole - Définition
La liste des auteurs de cet article est disponible ici.
Utilisation de l'Indole
L'essence naturelle de jasmin utilisé en parfumerie contient environ 2,5 % d'indole. La production de 1 kg d'essence naturelle requiert plusieurs millions de fleurs et coûte de l'ordre de 10 000 $. L'indole est donc utilisé (parmi d'autres composés) pour fabriquer de l'essence de jasmin synthétique, pour un coût de l'ordre de 10 $/kg.
L'indole est également le réactif de départ de la synthèse d'un grand nombre de composés organiques : pigments, composants de parfums, médicaments...
Synthèse et production de l'indole
La principale méthode industrielle de production d'indole est la distillation du goudron de houille, dont l'indole est l'un des constituants importants. L'indole est contenu dans la fraction de distillat obtenue entre 220 °C et 260 °C.
L'indole et ses dérivés peuvent également être synthétisés par une grande variété de réactions chimiques. Ce chapitre ne présente pas toutes les techniques de synthèse de manière exhaustive mais un panorama historique.
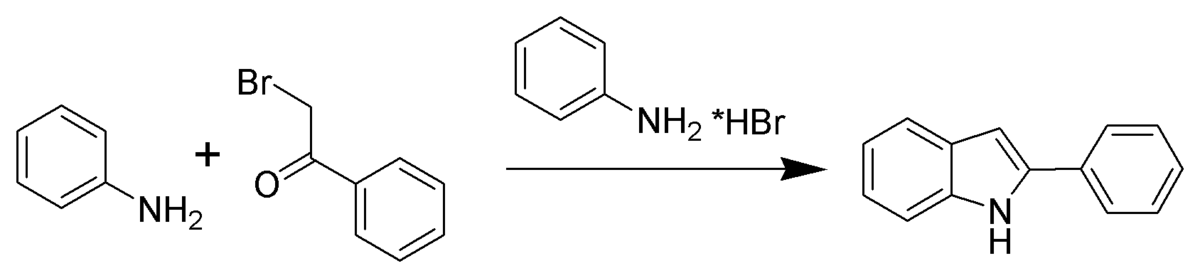
Synthèse de Bischler-Möhlau
Développée au cours de la décennie 1880, la méthode de Bischler-Möhlau est l'une des toutes premières techniques de synthèse de l'indole. Au cours de la réaction, de l'α-bromo-acétophénone réagit avec un excès d'aniline en milieu acide pour former un 2-aryl-indole. Cependant, elle ne permet pas de préparer directement de l'indole non substitué.
Synthèse de Fischer
La réaction Fisher indole est une réaction remarquable qui a été découverte par un des plus grands chimistes organiciens, Hermann Emil Fischer 1852-1919 (prix Nobel en 1902). La synthèse indolique de Fisher consiste à une addition de phenylhydrazine sur une cétone ou aldéhyde en milieu acide.
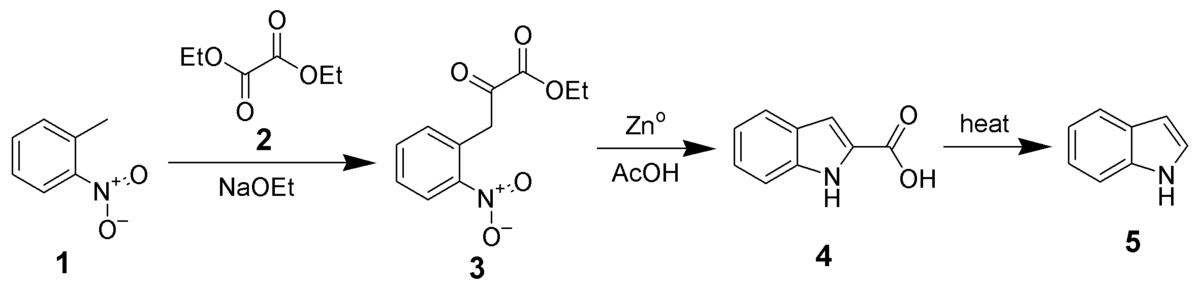
Synthèse de Reissert
Proposée en 1897, la synthèse de Reissert est l'une des première à permettre la synthèse d'indole non substitué, en trois étapes à partir d'ortho-nitrotoluène (1).
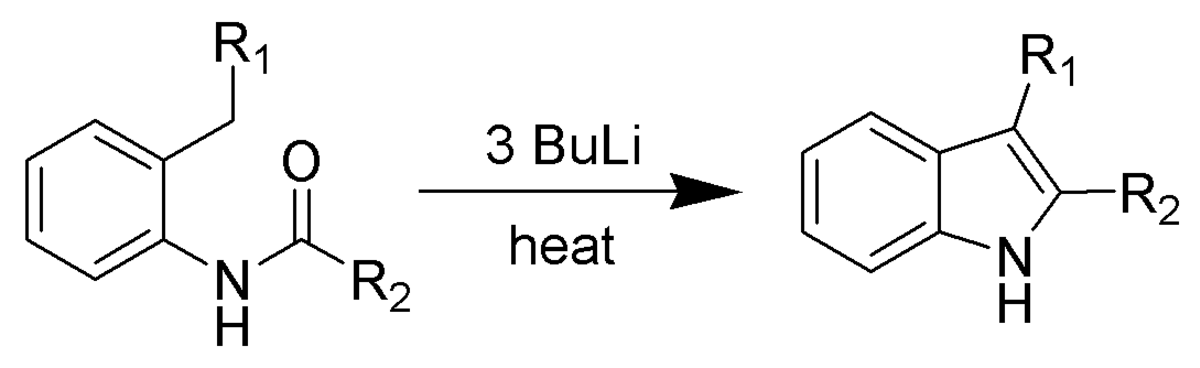
Synthèse de Madelung
La synthèse de Madelung, développée en 1912, est une réaction permettant la fabrication d'indole (substitué ou non substitué) par la cyclisation intramoléculaire d'un N-phénylamide. Elle se fait à haute température en présence d'une base forte.
Synthèse de Leimgruber-Batcho
La méthode de synthèse de l'indole de Leimgruber-Batcho, découverte et brevetée en 1976, permet de préparer de l'indole et des dérivés substitués avec un bon rendement. Elle est tout particulièrement utilisée dans l'industrie pharmaceutique pour préparer des médicaments dont la structure contient des dérivés indolés.
Cette synthèse s'effectue en deux étapes, à partir de l'ortho-nitrotoluène. Celui-ci est d'abord transformé en une énamine, qui est ensuite réduite pour obtenir l'indole.
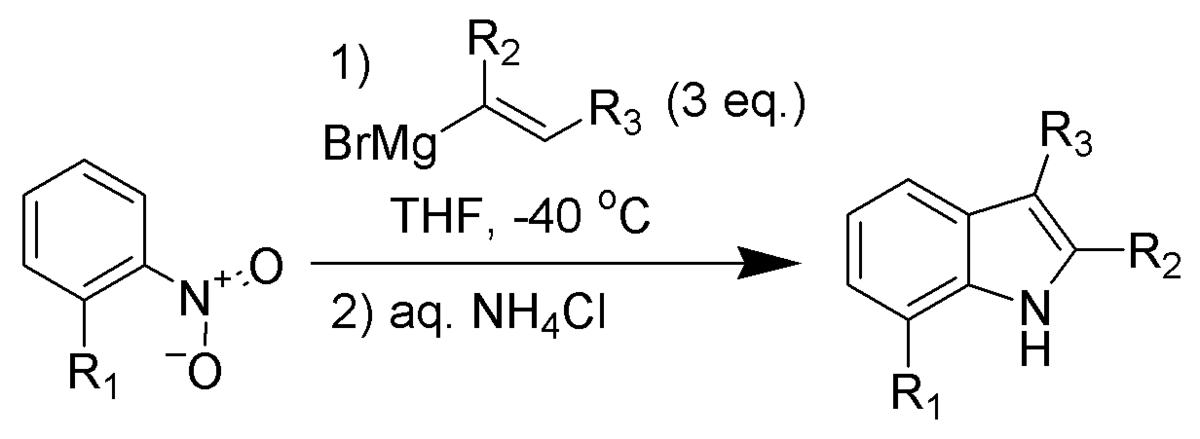
Synthèse de Bartoli
La synthèse de Bartoli est une méthode de synthèse d'indole substitué, à partir d'un nitrobenzène ortho-substituté et d'un organomagnésien vinyle.
Cette réaction ne fonctionne qu'avec un nitrobenzène substitué en position ortho (et ne marche pas sans). Trois équivalents en organomagnésien sont nécessaires pour la mener à bien.
Sécurité
L'indole peut réagir fortement avec les oxydants forts. C'est un composé irritant pour les yeux. En cas d'ingestion, il est irritant pour la bouche, la gorge, l’œsophage et le tube digestif.
Phrases de risque et conseils de prudence


- R: 21/22 (Nocif par contact avec la peau et par ingestion)
- R: 36 (Irritant pour les yeux)
- R: 50 (Très toxique pour les organismes aquatiques)
- S: 36/37 (Porter un vêtement de protection et des gants appropriés)
- S: 61 (Éviter le rejet dans l’environnement. Consulter les instructions spéciales/la fiche de données de sécurité)