Organomagnésien - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Les organomagnésiens sont des composés organiques possédant une liaison carbone–magnésium, ils font partie de la famille des organométalliques.
Les organomagnésiens mixtes ont pour structure commune : R—Mg—X, avec R la chaîne carbonée, Mg l'atome de magnésium, et X un atome halogène — principalement Cl, Br ou I, plus rarement F de par la faible polarisabilité du difluor F2.
C'est en 1912 que Victor Grignard, chimiste français, reçoit le prix Nobel de chimie pour la synthèse et les applications des « organomagnésiens mixtes » — les premiers organométalliques étudiés, en 1900, par Grignard. Les organomagnésiens mixtes sont d'ailleurs aussi appelés « réactifs de Grignard ».
Les organomagnésiens servent d'intermédiaires très utiles dans la fabrication d'autres composés : ils servent dans l'industrie pharmaceutique, mais aussi dans la synthèse des alcools.
Caractère organométallique des R—Mg—X
Le carbone a une électronégativité χ forte : χC = 2,55. Et on remarque aussi que

Les organomagnésiens sont une des bases au sens de Brönsted les plus fortes de la chimie organique avec un pKa de l'ordre de 40 à 60. R—Mg—X est un nucléophile puissant.
Réactivité des organomagnésiens
Réactions sur les composés organiques habituels
Sur l'eau
La réaction des organomagnésiens sur l'eau est très vive (c'est une réaction acido-basique:pKa(RH/R-)=50), et exothermique. C'est pour cela que le mode opératoire impose une deshydratation totale de l'air dans la verrerie, ainsi que des surfaces et solvants. Sauf cas particuliers, cette réaction est considérée comme parasite, et entraine la destruction de l'organomagnésien.
La réaction de l'organomagnésien sur l'eau est la suivante :
Avec les alcools
Avec les acides carboxyliques
Avec les amines
Avec les alcynes vrais
Réactions de substitution nucléophile
Substitution nucléophile, exemple de I2
On propose la substitution nucléophile de RMgX sur I2 (la polaritié de cette molécule est induite).
Substitution nucléophile avec les dérivés halogénés
Dérivé halogéné: R'-X mécanisme: SN
R-MgX + R'-X —> R-R' + MgX2
Remarque: fonctionne bien avec R-I et Ar-CH2X car ils sont stabilisés par effet inductif pour R-I et mésomère pour Ar-CH2X
Réaction sur les époxydes
mécanisme: SN2
Dans l'ether:
R----Mg----X + O(CH2)2 (cycle) ---> R-CH2-CH2-O-Mg-X
Puis Hydrolyse acide H3O+ :
R-CH2-CH2-O-Mg-X + H+ ---> R-CH2-CH2-OH + MgX
Réactions d'addition nucléophile…
… sur les aldéhydes et cétones
- Sur les aldéhydes :
La réaction entre les organomagnésiens et les aldéhydes mènent à la formation d'un alcool secondaire, si les chaines R1 et R2 contiennent au minimum un carbone. Si le carbone d'appui du groupement alcool final est asymétrique, c’est-à-dire si les deux chaines R sont différentes, le produit sera composé des deux isomères de configuration R et S.
- Sur les cétones :
Cette réaction conduit à la création d'un alcool tertiaire. Comme pour les aldéhydes, si le carbone formé est asymétrique, on obtient un mélange R/S 50/50 ; ainsi, il n'y a pas de stéréoselectivité. Un étude du mécanisme de la réaction montre qu'en fait il y a un intermédiaire cyclique:
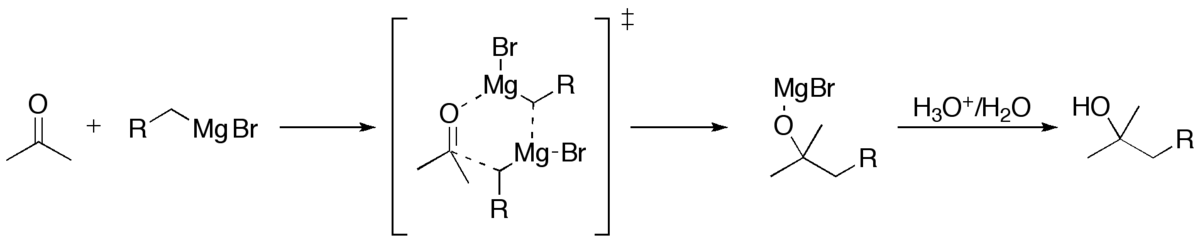
- Cas particulier de la synthèse d'un alcool primaire :
… sur les esters
La réaction est similaire à la réaction sur une cétone. Après hydrolyse, nous obtenons de manière intermédiaire l'hémiacétal;
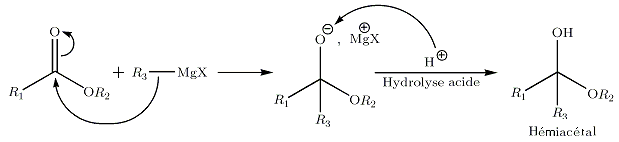
Celui-ci est instable, il subit une élimination conduisant à une cétone. L'organomagnésien présent va réagir chimiosélectivement avec la cétone avant l'ester, moins réactif car le noyau du carbone de son carbonyle est un peu masqué par les électrons non liants de l'oxygène lié par un liaison simple. Le bilan global de la réaction conduit donc à la formation d'un alcool tertiaire, sans possibilité d'isoler la cétone intermédiaire.
… sur les chlorures d'acyle
La réaction est similaire à la réaction sur une cétone mais plus rapide car le noyau du carbone lié au chlore montre une charge positive plus attirante pour le radical de l'organomagnésien.
R----Mg----X + R'-CO-Cl ---> R'-CO-R + Cl-Mg-X
La réaction conduit donc à la formation d'une cétone isolable s'il n'y a pas trop d'organomagnésien.
… sur le CO2
On utilise le dioxyde de carbone à l'état de carboglace. La réaction conduit à la formation d'un acide carboxylique R-COOH.