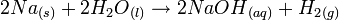Métal alcalin - Définition
La liste des auteurs de cet article est disponible ici.
Réactions
Réaction avec l'eau
Les métaux alcalins sont connus pour leur réaction violente avec l’eau. Cette violence augmente quand on descend dans l'ordre du groupe . Voici cette réaction:
Métal alcalin + eau
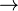
Exemple avec le sodium:
Cette réaction est très exothermique et met parfois feu au dihydrogène avec une flamme jaune. Avec le potassium au lieu du sodium, la flamme est de couleur lilas.
Les réactions des métaux alcalins avec l'eau peuvent être, selon les quantités mises en œuvre, très dangereuses.
Réaction dans l'ammoniac
Les métaux alcalins se dissolvent dans l'ammoniac liquide donnant des solutions bleues qui sont paramagnétiques
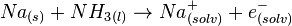
Vu la présence d'électrons libres, la solution occupe plus que la somme des volumes du métal et de l'ammoniac. Les électrons libres font de ces solutions de très bons agents réducteurs.
Identification
Émission atomique
Les vapeurs de métaux alcalins (ou de leurs ions) excités par la chaleur ou l'électricité sont connus pour émettre des couleurs caractéristiques. C'est ainsi que la spectroscopie a vu ses premiers pas se réaliser, grâce aux expériences de Bunsen et Kirchhoff. Les couleurs sont dues au fait que le spectre d'émission atomique est un spectre de raie, et non un spectre continu de type corps noir, preuve de la nature quantique des niveaux d'énergie dans les atomes et ions. Les couleurs caractéristiques sont :
- lithium : rose fuchsia intense ; de fait très utilisé en pyrotechnie,
- sodium : jaune-orangé intense ; utilisé en pyrotechnie et dans les ampoules d'éclairages publics,
- potassium : mauve pâle.