Nitrométhane - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Nitrométhane | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| Apparence | liquide visqueux incolore, d'odeur caractéristique. | ||
| Propriétés chimiques | |||
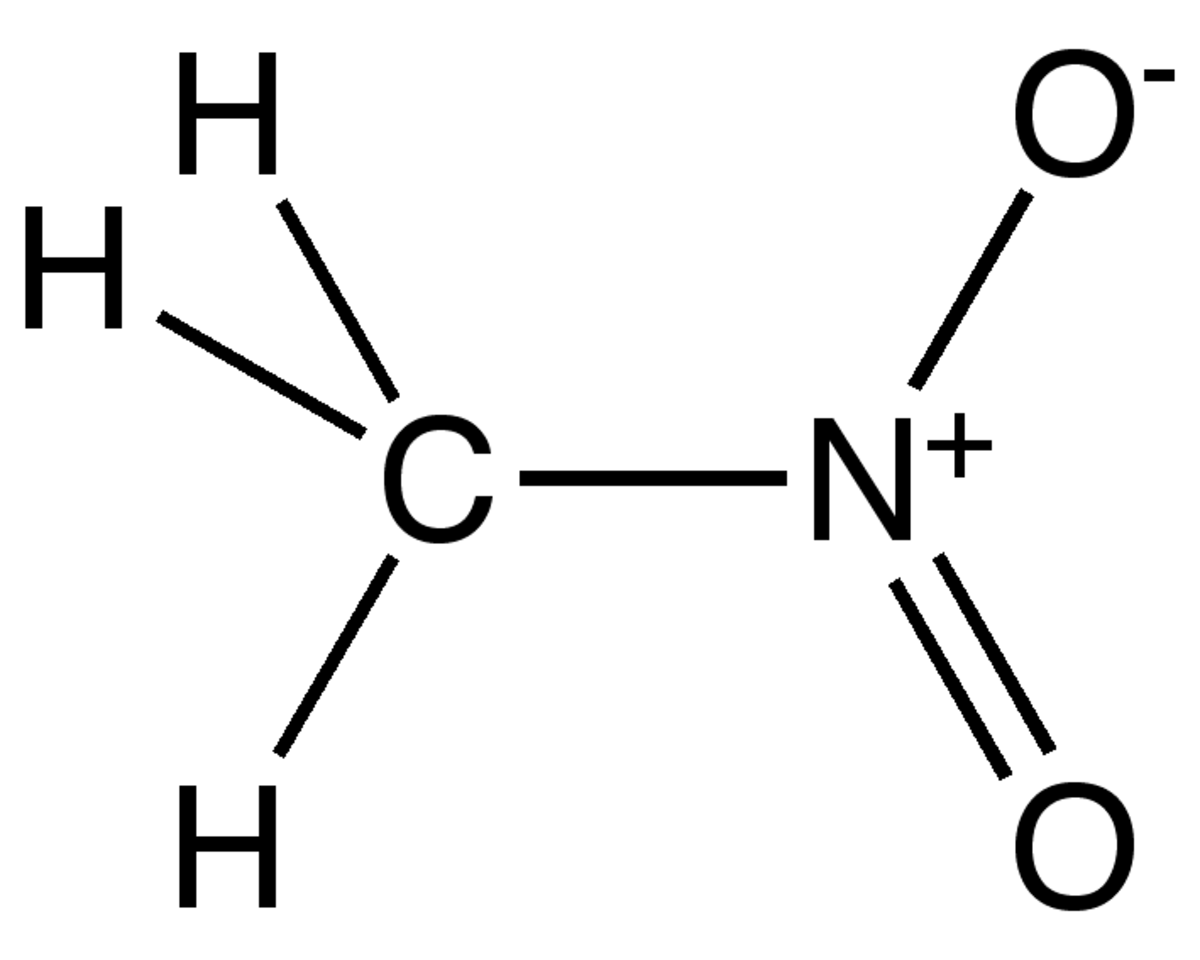
| Formule brute | CH3NO2 | ||
| Masse molaire | 61,04 ± 0,0018 g·mol-1 | ||
| Moment dipolaire | 3,46 ± 0,02 D | ||
| Diamètre moléculaire | 0,449 nm | ||
| Propriétés physiques | |||
| T° fusion | -29 °C | ||
| T° ébullition | 101 °C | ||
| Masse volumique | 1,137 g·cm-3, 2.11 (vapeur) | ||
| T° d’auto-inflammation | 417 °C | ||
| Point d’éclair | 35 °C (coupelle fermée) | ||
| Limites d’explosivité dans l’air | 7,3–60 %vol | ||
| Point critique | 63,1 bar, 314,85 °C | ||
| Point triple | 244,77 K (-28,38 °C) | ||
| Thermochimie | |||
| ΔH0 | -81 kJ/mol | ||
| ΔH0 | -113 kJ/mol | ||
| Cp | 106 J/mol.K (liquide) | ||
| Chaleur latente de vaporisation | 34 kJ/mol | ||
| Chaleur latente de fusion | 9,7 kJ/mol | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 11,08 ± 0,07 eV (gaz) | ||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| Phrases R : 5, 10, 22, | |||
| Phrases S : (2), 41, | |||
| | |||
| |||
| | |||
|
3 2/1 4 | |||
| | |||


Attention | |||
| | |||
| Groupe 2B : Peut-être cancérogène pour l'homme | |||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 3,5 ppm haut : 100 ppm | ||
| | |||
Le nitrométhane est un composé organique dont la formule chimique est CH3NO2. Il est le plus simple composé organique nitré. Il s'agit d'un liquide visqueux, hautement polaire habituellement utilisé comme solvant dans les applications industrielles, comme les extractions, en tant que réactif ou solvant de nettoyage. En tant qu'intermédiaire dans la synthèse organique, il est très utilisé dans la fabrication de produits pharmaceutiques, pesticides, explosifs et fibres. Il est également utilisé comme carburant à haut potentiel pour les véhicules de course.
Préparation
Le nitrométhane peut être synthétisé par réaction du chloroacétate de sodium avec le nitrite de sodium en solution aqueuse :
- ClCH2COONa + NaNO2 + H2O → CH3NO2 + NaCl + NaHCO3
Il est extrait du mélange réactionnel par distillation.
À l'échelle industrielle, il est produit par nitration du méthane en faisant réagir en phase vapeur le méthane et l'acide nitrique.




















































