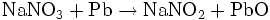Nitrite de sodium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Nitrite de sodium | ||||
|---|---|---|---|---|

| ||||
| Général | ||||
| Nom IUPAC | ||||
| No CAS | ||||
| No EINECS | ||||
| No E | E250 | |||
| Apparence | solide de formes variables hygroscopique, blanc a jaune. | |||
| Propriétés chimiques | ||||
| Formule brute | NaNO2 | |||
| Masse molaire | 68,9953 ± 0,0008 g·mol-1 | |||
| Propriétés physiques | ||||
| T° fusion | (décomposition) : 280 °C | |||
| T° ébullition | Se décompose au-dessous du point d'ébullition à 320 °C | |||
| Solubilité | dans l'eau à 20 °C : 820 g·l-1 | |||
| Masse volumique | 2,2 g·cm-3 | |||
| Précautions | ||||
| | ||||
| ||||
| Phrases R : 8, 25, 50, | ||||
| Phrases S : (1/2), 45, 61, | ||||
| | ||||
| ||||
| | ||||



Danger | ||||
| Écotoxicologie | ||||
| DL | 85 mg·kg-1 (rats) | |||
| | ||||
Le nitrite de sodium, de formule NaNO2, est le nitrite le plus important dans l'industrie chimique.
La masse molaire moyenne du nitrite de sodium est : 69,00 g.mol-1. L'ancienne méthode de fabrication était basée sur la réduction du nitrate de sodium par le plomb métallique à 420 °C :
On l'obtient de nos jours comme sous-produit lors de la synthèse industrielle de l’acide nitrique : on fait absorber à une solution d’hydroxyde de sodium un mélange de monoxyde d'azote et de dioxyde d'azote.
Utilisations
Antidote lors d'intoxication au cyanure
Le nitrite de sodium est injecté par voie intraveineuse immédiatement après l'ingestion accidentelle de cyanure. Il permet alors de minimiser la fixation des cyanures au Fe(II) de l'hémoglobine (très forte affinité) par formation de méthémoglobine (le fer de l'hème est oxydé à l'état de Fe(III)), dont l'affinité pour les ions cyanures est alors diminuée. Semble avoir été interdit par la Belgique comme conservateur de charcuterie emballée : haute toxicité (cancérigène) sur les rats.
Alimentaire
Le nitrite de sodium est un additif alimentaire utilisé comme agent conservateur (E250).