Enthalpie de changement d'état - Définition
L'enthalpie de changement d'état, molaire ou massique, correspond à la quantité de chaleur nécessaire à l'unité de quantité de matière (mole) ou de masse (kg) d'un corps pour qu'il change d'état; cette transformation ayant lieu à température et pression constantes. Par exemple pour le passage de l'état liquide à l'état de vapeur on parlera d'enthalpie de vaporisation.
L'enthalpie échangée lors du changement d'état résulte de la modification (rupture ou établissement) de liaisons interatomiques ou intermoléculaires. Il existe trois états physiques principaux pour tout corps pur: l'état solide, l'état liquide et l'état gazeux. Les liaisons sont plus fortes dans l'état solide que dans l'état liquide et ces liaisons sont quasi-absentes dans l'état gazeux. Il existe un quatrième état obtenu à très haute température où la matière se trouve sous la forme d'un plasma d'ions et d'électrons.
Par exemple, l'eau bout à 100 °C sous la pression d'1 atmosphère ( 1atm = 101325 Pascal). L'enthalpie de vaporisation de l'eau, égale à la quantité de chaleur fournie pour transformer l'eau liquide en vapeur, est de 2257 kJ/kg.
Enthalpies de changement d'état de diverses substances
| Corps simples solides |
Enthalpie de | |
|---|---|---|
| fusion kJ/kg |
vaporisation kJ/kg |
|
| Aluminium | 393 | |
| Antimoine | 163 | 1340 |
| Argent | 103 | 2160 |
| Béryllium | 1339 | |
| Bismuth | 43 | 858 |
| Cadmium | 45 | 1004 |
| Calcium | 2430 | |
| Césium | 16 | |
| Chrome | 316 | |
| Cobalt | 259 | |
| Cuivre | 205 | 4650 |
| Étain | 59 | 2600 |
| Fer | 207 | |
| Gallium | 80 | |
| Lithium | 137 | |
| Magnésium | 369 | 8450 |
| Manganèse | 101 | |
| Nickel | 298 | |
| Palladium | 152 | |
| Phosphore blanc | 21 | 540 |
| Platine | 114 | |
| Plomb | 23 | 920 |
| Rubidium | 26 | |
| Sélénium | 56 | |
| Soufre clinorhombique | 39 | |
| Thallium | 15 | |
| Tellure | 31 | |
| Zinc | 96 | 1820 |
| Autres substances | ||
| Méthane | 510 | |
| Éthane | 489 | |
| Propane | 426 | |
| Butane | 385 | |
| n-Pentane | 357 | |
| Isopentane | 339 | |
| n-Hexane | 337 | |
| n-Heptane | 320 | |
| n-Octane | 306 | |
| Éthylène | 483 | |
| Propylène | 438 | |
| But-1-ène | 391 | |
| Isobutène | 394 | |
| Cyclopentane | 390 | |
| Cyclohexane | 358 | |
| Acétylène | 829 | |
| Benzène | 394 | |
| Toluène | 363 | |
| o-Xylène | 347 | |
| Cumène | 312 | |
| Méthanol | 1100 | |
| Éthanol | 855 | |
| Propanol | 695 | |
| Isopropanol | 667 | |
| n-Butanol | 591 | |
| Acétaldéhyde | 570 | |
| Acétone | 521 | |
| Diéthyléther | 377 | |
| Essence automobile | 335 | |
| Eau | 330 | 2256 |
| Ammoniac | 1391 | |
Dans le tableau ci-contre, la chaleur de vaporisation correspond à la température d'ébullition du corps sous une pression égale à l'atmosphère au niveau de la mer (101,3 kPa).
Fusion des solides
L'entropie molaire de fusion des métaux est comprise entre 4 et 16 kJ/(mol.K), sauf rare exception. Cette règle permet de connaître une valeur approchée de l'enthalpie de fusion, connaissant la température de fusion :
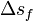
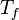
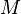
Histoire
On nommait autrefois chaleur latente cette grandeur, en référence à la vision substantialiste de la chaleur (considérée comme un fluide, une substance, immatérielle) qui était largement répandue jusqu'au XIXe siècle avec notamment les travaux de Joseph Fourier sur cette dernière.